-
【 通用名称 】
小儿法罗培南钠颗粒
-
【 商 品 名 】
菲若姆®
-
【 规格 】
0.05g (按C12H15NO5S计算)。
-
【 包装 】
复合膜袋包装:3袋/盒、6袋/盒、9袋/盒。
-
【 批准文号 】
进口药品注册证号:H20180001
大包装进口药品注册证号: H20191006
分包装批准文号:国药准字J20190005
-
【 适应症 】
本品为颗粒剂,主要用于对法罗培南敏感的细菌所致的儿童下列 感染性疾病的治疗。
本品适用于对法罗培南敏感的葡萄球菌属、链球菌属、肺炎链球菌、 肠球菌属、卡他莫拉克氏菌、大肠杆菌、枸橼酸杆菌、克雷伯氏杆菌、奇 异变形杆菌、流感嗜血杆菌及百日咳菌引起的儿童下列感染性疾病的治疗:
浅表皮肤及皮肤组织感染、深层皮肤及皮肤组织感染、淋巴管炎、淋 巴结炎、慢性皮肤化脓性疾病、咽喉炎、扁桃体炎、急性支气管炎、肺炎、 膀胱炎、肾孟肾炎、中耳炎、鼻窦炎、牙周组织炎、猩红热、百日咳。
-
【 说明书 】
|
【
药品名称
】
|
通用名称:小儿法罗培南钠颗粒 商品名称:菲若姆 英文名称: Pediatric Faropenem Sodium Granules 汉语拼音: Xiao'er Faluopeinanna Keli |
||||||||||||||||||||||||||||||||||||
|
【
成份
】
|
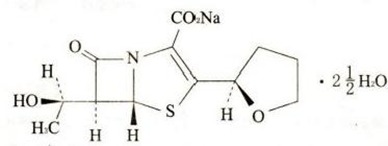
本品主要成份为法罗培南钠水合物。 化学名称:(5R,6S)-6-[(1R)-1-羟乙基]-7-氧代-3-[(2R)-四氢呋喃-2-基] -4-硫杂-1-氮杂双环[3.2.0]庚-2-烯-2-羧酸钠盐二倍半水合物 化学结构式:
分子式:C12H14NNaO5S·2 分子量:352.34 |
||||||||||||||||||||||||||||||||||||
|
【
性状
】
|
本品为橙色颗粒。 |
||||||||||||||||||||||||||||||||||||
|
【
适应症
】
|
本品为颗粒剂,主要用于对法罗培南敏感的细菌所致的儿童下列 感染性疾病的治疗。 1、儿童患者 本品适用于对法罗培南敏感的葡萄球菌属、链球菌属、肺炎链球菌、 肠球菌属、卡他莫拉克氏菌、大肠杆菌、枸橼酸杆菌、克雷伯氏杆菌、奇 异变形杆菌、流感嗜血杆菌及百日咳菌引起的儿童下列感染性疾病的治疗: 浅表皮肤及皮肤组织感染、深层皮肤及皮肤组织感染、淋巴管炎、淋 巴结炎、慢性皮肤化脓性疾病、咽喉炎、扁桃体炎、急性支气管炎、肺炎、 膀胱炎、肾孟肾炎、中耳炎、鼻窦炎、牙周组织炎、猩红热、百日咳。 |
||||||||||||||||||||||||||||||||||||
|
【
规格
】
|
0.05g (按C12H15NO5S计算)。 |
||||||||||||||||||||||||||||||||||||
|
【
用法用量
】
|
1、用法 将本品适量用水溶解后口服。 本品需临用时配制,配制后不能长时间放置,用水溶解后应迅速用药, 必要时可放在冰箱内保存,但也应尽快使用。 2、 用量 应由医生根据感染类型、严重程度及病人的具体情况适当增减本药 剂量。 为防止出现耐药菌株,原则上应做细菌敏感性试验,并在保证疗效的 前提下使用最短的疗程。 儿童推荐用量: 通常,儿童每次5mg/kg, 每日3次。可根据年龄、体重、症状酌情增 减剂量。增加剂量不得超过每次10mg/kg。年龄较大的儿童,剂量不得超 过成人剂量的上限,即每次300mg, 每日900mg。
|
||||||||||||||||||||||||||||||||||||
|
【
不良反应
】
|
目前尚无本品用于国内临床的详细不良反应信息,国外已上市法罗培 南钠干糖浆和法罗培南钠片的不良反应信息如下。 1、法罗培南钠干糖浆 在获得批准时的临床试验中,在共计587例中48例(8.2%)出现不良反应,主要不良反应有腹泻35例(6.0%)、稀便9例(1.5%)。 此外,临床检查值异常病例如下:嗜酸性粒细胞增多22例(6.8%)、 谷丙转氨酶 (ALT(GPT)) 升高15例(4.9%)、谷草转氨酶 (AST(GOT)) 升高11例(3.6%)。 上市后的使用调查结果:在共计3613例中367例(10.2%)出现不良 反应,主要不良反应有腹泻、稀便349例(9.7%)、皮疹10例(0.3%)、 呕吐4例(0.1%),荨麻疹3例(0.1%)(截止到2005年再审查结束时)。 1)严重的不良反应 (1)休克(低于0.1%)、过敏样症状(发生率不明):有时可能引起 休克、过敏样症状,故须密切观察。 一旦出现不适感、口内异常、喘鸣、 呼吸困难、眩晕、便意、耳鸣、出汗、全身潮红、血管浮肿、低血压等症 状时,应停药并做适当治疗。 (2)急性肾功能不全(发生率不明):有时可能发生包括急性肾功能 不全等严重肾功能障碍,在确认发生这种异常时,应停药并做适当治疗。 (3)伴发血便的伪膜性结肠炎等严重大肠炎(发生率不明):有时可 能出现伴发血便的伪膜性结肠炎等严重大肠炎,故须密切观察,在出现腹 痛、频繁腹泻等症状时,应立即停药并做适当治疗。 (4)皮肤黏膜眼综合症 (Stevens-Johnson综合征)、中毒性表皮坏死 症 (Lyell 综合征) (发生率不明):因有时可能发生皮肤粘膜眼综合症 (Stevens-Johnson综合征)、中毒性表皮坏死症 (Lyell综合征)等症状, 故须密切观察,在出现这类症状时应停药并做适当治疗。 (5)间质性肺炎(发生率不明):有时可能出现伴有发热、咳嗽、呼 吸困难、胸部X线检查异常等症状的间质性肺炎,在发现这些症状时应停药 并采取给予肾上腺皮质激素类药物等适当治疗措施。 (6)肝功能障碍、黄疸(低于0.1%):有时可能出现谷草转氨酶(AST (GOT))、 谷丙转氨酶 (ALT( GPT))、 碱性磷酸酶(Al-P) 升高及黄疸,应定期检查肝功能, 一旦确认异常时应停药并做适当治疗。 (7)粒细胞缺乏症(发生率不明):有时可能出现粒细胞缺乏症,应密切观察, 一旦确认发现异常,应停药并做适当治疗。 (8) 横纹肌溶解症(发生率不明):有时可能出现以肌痛、无力、肌 酸磷酸激酶(CK(CPK)) 升高、血液和尿中肌红蛋白升高等为特征的横纹 肌溶解症,还可能伴有急性肾功能不全等严重肾功能障碍,在出现上述症 状时,应停药并采取做适当治疗。 2) 严重的不良反应(同类药物) 嗜酸性细胞增多性肺浸润综合症 (PIE 综合症):曾有报道,同类化合物(头孢类、碳青霉烯类药物)可引起发热、咳嗽、呼吸困难、胸 部X线异常、嗜酸性粒细胞增多等PIE综合征,若出现上述症状应停药,并采取给予肾上腺皮质激素等适当治疗措施。
注1)根据片剂及儿童用干糖浆批准时及再审查期间使用情况的调查结 果(总病例20,916例、特别调查63例,上市后临床试验17例)统 计不良反应发生率。 注2)须充分观察,在出现上述症状时应停药,并采取适当措施。 注3)根据儿童用干糖浆获得批准时的试验结果,嗜酸性粒细胞增多变 更为22例(6.8%)。 注4)根据儿童用干糖浆获得批准及上市后的使用结果,腹泻、稀便 393例(9.5%)、荨麻疹5例(0.1%)、呕吐4例(0.1%)。出现上 述症状应停药,并采取适当措施。 注5)本品可能导致儿童臀部浅表性皮肤念珠菌感染,须充分观察, 在出现上述症状时,应停药并采取适当措施。 2、法罗培南钠片 在获得批准时的临床试验中,在共计2207例中127例(5.8%)出现不 良反应,主要不良反应有腹泻55例(2.5%)、腹痛19例(0.9%)、稀便15 例(0.7%)、皮疹13例(0.6%)、恶心12例(0.5%)。 此外,临床检查值异常病例:谷丙转氨酶 (ALT(GPT)) 升高56例 (3.4%)、谷草转氨酶(AST(GOT)) 升高36例(2.2%)、嗜酸性粒细胞增多27例(1.8%)。 上市后的调查结果,在共计17383例中528例(3.0%)出现不良反应, 主要不良反应有腹泻、稀便365例(2.1%)、腹痛26例(0.2%)、皮疹25 例(0.1%)。 严重的不良反应、严重的不良反应(同类药物)及其他不良反应同上 述法罗培南钠干糖浆不良反应相同项下内容。 |
||||||||||||||||||||||||||||||||||||
|
【
禁忌
】
|
对本品成份有休克史的患者禁用; 对本品成份有过敏史的患者原则上禁用。 |
||||||||||||||||||||||||||||||||||||
|
【
注意事项
】
|
1. 以下患者应慎用 (1)对青霉素类、头孢菌素类或碳青霉烯类药物有过敏史的患者。 (2)患者本人或父母、兄弟姐妹等为易于发生支气管哮喘,皮疹,荨 麻疹等变态反应症状体质者。 (3)经口摄取不良的患者或正接受非口服营养疗法的患者、全身状态 不良的患者(有时会出现维生素K缺乏症,需注意严密观察)。 (4)腹泻患者(可能导致腹泻症状恶化,需注意严密观察)。 (5)严重肾功能障碍患者(本品主要通过肾脏排泄,肾功能损伤可导 致药物半衰期延长,血药浓度长时间持续较高浓度,因此应适当减少 给药量或延长间隔时间)。 2. 使用时注意 (1)服用本品可能发生休克,所以应予以充分诊察。 (2)本品最常见的不良反应为腹泻、稀便,因此出现下列症状时, 须控制给药量并注意观察大便的状况。若出现腹泻、稀便等症状, 则应根据所出现的症状、程度及经过采取适当的措施(包括停药)。 此外,在发现腹泻、稀便时应注意观察经过,患者或监护者应接受医 师指导(详见【不良反应】项)。 1)腹泻、稀便等副作用的发生率:3岁以下儿童(13.5%)比3岁以上 儿童(4.0%)高,因此3岁以下婴幼儿服用本品时更应严密观察。 2)腹泻、稀便等症状多出现在给药后3天内这段时间,因此在给药初 期尤须注意观察。 3)随着单次给药剂量增加,腹泻、稀便的发生率有增高的趋势 (5mg/kg 为5.4%,7.5mg/kg 为9.2%,10mg/kg 为10 .9%),需注意 给药剂量。 (3)本品可能导致儿童臀部浅表性皮肤念珠菌感染,须充分观察,在出现 上述症状时,应停药并采取适当措施。 (4)对临床检查的影响 1)除尿糖试带 (Tes tape) 反应以外,班氏试剂 (Benedict 试剂)、弗 林氏试剂 (Fehling 试剂)、含硫酸铜的片状试剂 (Clinitest) 尿糖检 查呈假阳性反应。 2)可能导致直接库姆斯试验呈阳性结果。
|
||||||||||||||||||||||||||||||||||||
|
【
孕妇及哺乳期妇女用药
】
|
对孕妇或可能妊娠妇女,除非能够判断治疗益处超过潜在风险时才能服 用本品(孕妇用药的安全性尚未确立)。 因本品可分布到母乳中,使用本品时应避免哺乳。
|
||||||||||||||||||||||||||||||||||||
|
【
儿童用药
】
|
本品为颗粒剂,对低出生体重婴儿、新生儿的安全性尚未确立(无使用经 验)。 |
||||||||||||||||||||||||||||||||||||
|
【
老年用药
】
|
本品为颗粒剂,主要用于对法罗培南敏感的细菌所致的儿童感染性疾病 的治疗。本品也可用于对法罗培南敏感的细菌所致的成人感染性疾病的 治疗。 老年患者需慎用,并需特别注意以下事项,从每次150mg 开始给药,注意 观察患者的状态慎重给药(因老年人一般生理功能较低,易出现不良 反应)。 1、对老年患者的人体药代动力学试验表明,与健康成年人相比,老年患 者的血液半衰期延长,长时间保持较高的血药浓度,可能与年龄增加而肾 功能低下有关。 2、老年患者的腹泻、软便等症状很可能导致全身症状恶化,因此须充分 观察,在出现上述症状时应停药并采取适当措施。 3、老年患者可能发生维生素K缺乏所致出血倾向。
|
||||||||||||||||||||||||||||||||||||
|
【
药物相互作用
】
|
本品与下列药物合用时要注意:
|
||||||||||||||||||||||||||||||||||||
|
【
药物过量
】
|
尚不明确。 |
||||||||||||||||||||||||||||||||||||
|
【
药理毒理
】
|
药理作用 法罗培南钠为具青霉烯基本骨架的青霉烯类口服抗生素。它通 过阻止细菌细胞壁合成而发挥抗菌、杀菌作用。对各种青霉素结合 蛋白 (PBPs) 具有高亲和性,特别是对细菌增殖所必需的高分子PBP 呈现高亲和性。 体外试验显示:法罗培南钠对需氧性革兰阳性菌、需氧性革兰 阴性菌及厌氧菌具有广泛抗菌谱;尤其对需氧性革兰阳性菌中的葡 萄球菌、链球菌、肺炎球菌、肠球菌,需氧性革兰阴性菌中的枸橼 酸杆菌、肠杆菌、百日咳菌及厌氧菌中的消化链球菌、拟杆菌、普 雷沃菌等显示较强杀菌作用。并对各种细菌产生β-内酰胺酶稳定, 对产生β-内酰胺酶的细菌亦具有较强抗菌活性。
毒理研究 遗传毒性 Ames试验、培养细胞基因突变试验和染色体异常试 验、小鼠微核试验结果均未发现法罗培南钠具有致突变性。 生殖毒性 大鼠在器官形成期经口给药320、800和2000mg/kg, 在妊娠前和妊娠初期及围产期、哺乳期经口给药80、360和1620mg/ kg, 结果除了见大鼠摄食量发生轻度变化外,总体状态和体重均无变化。试验结果显示法罗培南钠对母鼠生殖功能、胎鼠和新生鼠没有影响,且未发现药物存在致畸性。 家兔在器官形成期静脉给药50、100和200mg/kg, 结果100mg/kg以 上给药组出现软便、腹泻和流产;200mg/kg给药组发生母兔死亡、 胎兔死亡数量增加和胎兔轻度发育迟缓,但试验未见法罗培南钠存在 致畸性。 重复给药毒性 大鼠和犬连续26周经口给予100、450和2000mgkg, 结果大鼠450mg/kg以上给药组出现β-球蛋白水平降低,2000mgkg给药组出现一过性摄食量减少,γ-GTP值降低等症状。但2000mg/kg组未见大鼠死亡。在犬450mg/kg以上给药组中发生红血球系水平降低。法罗培南钠对大鼠和犬的无毒性剂量均为100mg/kg。 |
||||||||||||||||||||||||||||||||||||
|
【
药代动力学
】
|
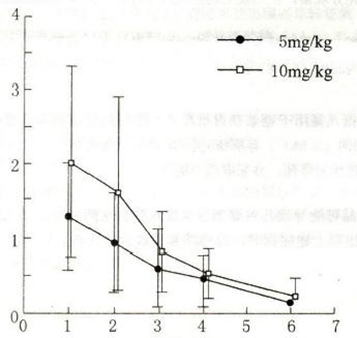
文献介绍的儿童的药代动力学研究如下: 儿童药代动力学 (1)血药浓度 儿童患者于饭后口服用药5、10mg/kg, 约1小时后血药浓度达峰,分 别为1.3、2.1μg/mL, 半衰期约为1小时。
儿童患者饭后口服给药的药动学参数(平均值土标准差)
(2)组织分布(法罗培南钠片,成人用药) 患者的痰液、拔牙后的创口渗出液、皮肤组织、扁桃体、上颌窦 粘膜组织及前列腺组织中均有分布。 (3)代谢(法罗培南钠片,成人用药) 本品以原形吸收,部分以原型药物自尿排泄,其余经肾中的脱氢 肽酶-1 (DHP-1) 代谢后从尿消除。人血浆及尿中没有发现具有抗菌活 性的法罗培南钠代谢物。 ( 4 ) 排 泄 主要经肾脏排泄。儿童(饭后)口服5、10mg/kg, 尿排泄率(0~6 小时)分别为3.7%及3.1%,5mgkg组给药后2~4小时尿药浓度达峰(27μg/ ml),10mg/kg 组给药后0~2小时尿药浓度达峰(41μg/ml)。 |
||||||||||||||||||||||||||||||||||||
|
【
贮藏
】
|
避光,密封,不超过25℃保存。 |
||||||||||||||||||||||||||||||||||||
|
【
包装
】
|
复合膜袋包装:3袋/盒、6袋/盒、9袋/盒。 |
||||||||||||||||||||||||||||||||||||
|
【
有效期
】
|
36个月 |
||||||||||||||||||||||||||||||||||||
|
【
执行标准
】
|
【执行标准】进口药品注册标准JX20190204 |
||||||||||||||||||||||||||||||||||||
|
【
批准文号
】
|
进口药品注册证号:H20180001 大包装进口药品注册证号: H20191006 分包装批准文号:国药准字J20190005 |
||||||||||||||||||||||||||||||||||||
|
【
药品上市许可持有人
】
|
企业名称: Maruho Co.. Ltd. (玛路弘株式会社) 地址:1-5-22 Nakatsu, Kita-ku, Osaka, Japan 邮政编码:531-0071 电话号码:+81-(0)120-12-2834 |
||||||||||||||||||||||||||||||||||||
|
【
生产企业
】
|
企业名称: 中国化学制药股份有限公司台南四厂 CHINA CHEMICAL & PHARMCEUTICAL C0.,LTD. Tainan Plant IV 生产地址:No. 46-2,Gongye W.RD.,Guantian Dist.,Taian City 720008,Taiwan,R.0.C. |


 H2O
H2O