朗天药业荣获湖北省制造业单项冠军企业
近日,由湖北省经济与信息化厅主办的2025年全省制造业优质企业与基金供需对接暨制造业单项冠军企业培育活动在咸宁举办。朗天药业(湖北)有限公司被授予“湖北省制造业单项冠军企业(血塞通滴丸)”。
公司核心产品“血塞通滴丸”为创新剂型,所用药材三七来自云南文山道地药材,采用现代提取分离技术,摒弃药材中无效杂质;建立指纹图谱质控体系,确保批次间质量一致性;借助于载体以细微晶体或分子状态分散于水中,使得药物溶出速率加快。拥有以下显著优势:(1)每丸重28mg,含三七总皂苷10mg,纯度高、辅料少,具有更高的生物利用度;(2)可吞服,可含服,崩解时间短,起效快,依从性好,安全性优;(3)体积远小于其他口服剂型,更适合心脑血管伴吞咽困难的患者;(4)具有活血祛瘀,通脉活络的功效,广泛用于脑络瘀阻所致中风偏瘫,心脉瘀阻所致胸痹心痛,脑血管后遗症,冠心病心绞痛等疾病的治疗;(5)医院覆盖率最高,覆盖全国31个省市,二级以上医院4200余家、基层医疗机构50000余家。血塞通滴丸临床价值显著,用药安全,为广大心脑血管疾病患者提供更优质的用药选择。
朗天药业是朗天医药集团旗下集药品研发、生产和销售于一体的国家高新技术企业,拥有智能化冻干粉针剂、小容量注射剂、雾化吸入溶液和中药滴丸、丸剂生产线,其中智能化滴丸生产线填补湖北省在该领域的空白,是“湖北省工业质量标杆企业”和“湖北省金种子企业”。公司将以“湖北省制造业单项冠军企业”这一殊荣为契机,在心脑血管细分领域进一步深耕细作,为我国心脑血管疾病防治事业贡献更好的力量。
朗天药业荣获湖北省制造业单项冠军企业
近日,由湖北省经济与信息化厅主办的2025年全省制造业优质企业与基金供需对接暨制造业单项冠军企业培育活动在咸宁举办。朗天药业(湖北)有限公司被授予“湖北省制造业单项冠军企业(血塞通滴丸)”。
公司核心产品“血塞通滴丸”为创新剂型,所用药材三七来自云南文山道地药材,采用现代提取分离技术,摒弃药材中无效杂质;建立指纹图谱质控体系,确保批次间质量一致性;借助于载体以细微晶体或分子状态分散于水中,使得药物溶出速率加快。拥有以下显著优势:(1)每丸重28mg,含三七总皂苷10mg,纯度高、辅料少,具有更高的生物利用度;(2)可吞服,可含服,崩解时间短,起效快,依从性好,安全性优;(3)体积远小于其他口服剂型,更适合心脑血管伴吞咽困难的患者;(4)具有活血祛瘀,通脉活络的功效,广泛用于脑络瘀阻所致中风偏瘫,心脉瘀阻所致胸痹心痛,脑血管后遗症,冠心病心绞痛等疾病的治疗;(5)医院覆盖率最高,覆盖全国31个省市,二级以上医院4200余家、基层医疗机构50000余家。血塞通滴丸临床价值显著,用药安全,为广大心脑血管疾病患者提供更优质的用药选择。
朗天药业是朗天医药集团旗下集药品研发、生产和销售于一体的国家高新技术企业,拥有智能化冻干粉针剂、小容量注射剂、雾化吸入溶液和中药滴丸、丸剂生产线,其中智能化滴丸生产线填补湖北省在该领域的空白,是“湖北省工业质量标杆企业”和“湖北省金种子企业”。公司将以“湖北省制造业单项冠军企业”这一殊荣为契机,在心脑血管细分领域进一步深耕细作,为我国心脑血管疾病防治事业贡献更好的力量。
 “仿创结合、中西并举”驱动增长,朗天医药集团亮相第91届药交会
11月19日,第91届全国药品交易会在南京国际博览中心隆重开幕,作为中国乃至全球医药领域的盛会,本届药交会以“构建医药健康创新共融新生态”为主题,展览规模达10万平米,吸引国内外2000多家企业参展,预计参展人数将突破10万人次。
图为:开幕式盛况
图为:朗天医药集团展台
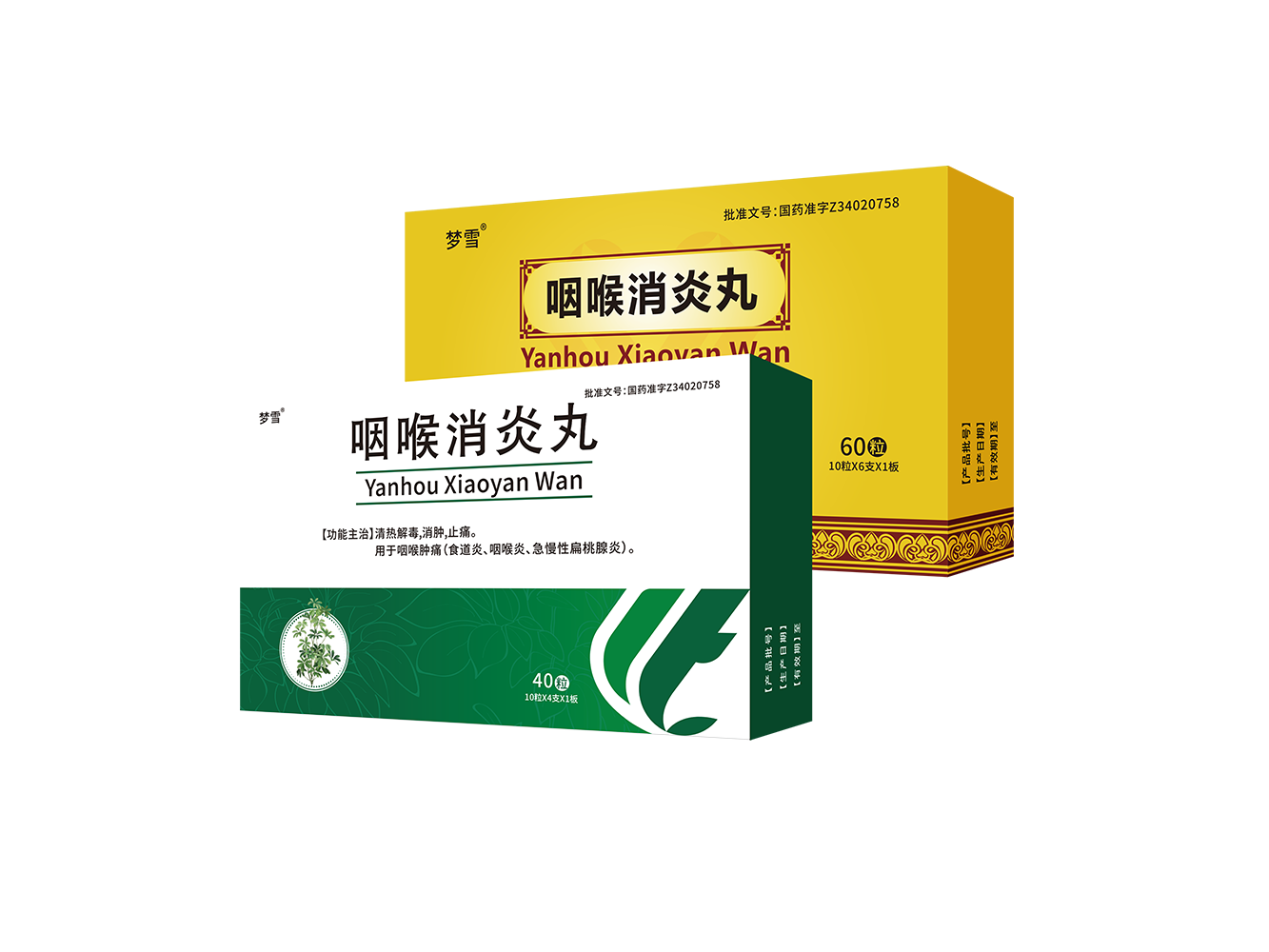
朗天医药集团在9号馆门口精彩亮相,展区内血塞通滴丸(集采中选)、回生再造丸(经典名方)、咽喉消炎丸以及最新上市的盐酸甲氧氯普胺注射液(集采中选)、注射用尼可地尔、帕拉米韦注射液等产品琳琅满目,展现了企业在中药传承与化药创新的活力。
展会期间,董事长蔡翔率公司高管亲临展台,会见了多家重要合作伙伴及潜在客户,深入交流,分析趋势,展望愿景。集团展台人流如织,气氛热烈,参展团队与各地客商介绍产品,洽谈意向。
图为:蔡翔董事长与医药同仁交流中
朗天集团的血塞通滴丸以精选的三七剪口入药,高浓缩工艺,凭借卓越品质,再次中选全国中成药采购联盟集中采购,在全国各等级及基层医疗机构得到了广泛使用,在治疗心脑血管疾病方面受到良好反馈,彰显了企业在产品质量和信誉方面的综合实力,成为展会的亮点之一。
图为:展区现场客户交流
本届展会进一步提升了集团品牌形象。集团将开拓更多新品,提升服务品质,深化伙伴关系,实现合作共赢,为推动中国大健康医药产业的发展贡献力量。
“仿创结合、中西并举”驱动增长,朗天医药集团亮相第91届药交会
11月19日,第91届全国药品交易会在南京国际博览中心隆重开幕,作为中国乃至全球医药领域的盛会,本届药交会以“构建医药健康创新共融新生态”为主题,展览规模达10万平米,吸引国内外2000多家企业参展,预计参展人数将突破10万人次。
图为:开幕式盛况
图为:朗天医药集团展台
朗天医药集团在9号馆门口精彩亮相,展区内血塞通滴丸(集采中选)、回生再造丸(经典名方)、咽喉消炎丸以及最新上市的盐酸甲氧氯普胺注射液(集采中选)、注射用尼可地尔、帕拉米韦注射液等产品琳琅满目,展现了企业在中药传承与化药创新的活力。
展会期间,董事长蔡翔率公司高管亲临展台,会见了多家重要合作伙伴及潜在客户,深入交流,分析趋势,展望愿景。集团展台人流如织,气氛热烈,参展团队与各地客商介绍产品,洽谈意向。
图为:蔡翔董事长与医药同仁交流中
朗天集团的血塞通滴丸以精选的三七剪口入药,高浓缩工艺,凭借卓越品质,再次中选全国中成药采购联盟集中采购,在全国各等级及基层医疗机构得到了广泛使用,在治疗心脑血管疾病方面受到良好反馈,彰显了企业在产品质量和信誉方面的综合实力,成为展会的亮点之一。
图为:展区现场客户交流
本届展会进一步提升了集团品牌形象。集团将开拓更多新品,提升服务品质,深化伙伴关系,实现合作共赢,为推动中国大健康医药产业的发展贡献力量。
 匠心筑品质 共绘质量梦——朗天药业(湖北)有限公司举行比学考试系列活动纪实
9月10日,恰逢中国教师节,朗天药业(湖北)有限公司举行了一场涉及全员的“专业大考”——覆盖GMP无菌附录、中药生产管理规定、受托生产管理规定等等的全员比学考试。
这场考试不是一次简单的“答题测验”,而是我们守护产品质量、守住行业底线的“能力校准”。
“无菌”是药品安全的底线,“中药生产”则承载着传统技艺的传承与现代标准的融合。无菌附录里,从洁净区穿戴规范到设备消毒流程,每一条都是规避污染风险的“硬要求”。
中药生产管理规定中,从中药材源头鉴别,到成品质量检验,每一步都是守护中药“疗效”与“安全”的关键。
随着公司的业务发展,受托生产成为我们生产链条的重要组成部分。作为受托方,我们承接的不仅是生产任务,更是委托方的信任与产品的质量责任。这份规定清晰界定了我们的职责:从生产前的文件审核、物料管理,到生产中的过程控制、偏差处理,再到生产后的成品交付、记录留存,每一个环节都要“按规操作、有据可查”。“受托”不是“简单代工”,而是要以更高的标准、更严的要求。 我们既要用无菌标准守住“安全底线”,也要以中药生产规范传承“品质匠心”,更要把委托方的质量需求落到实处。
这次“比学考试”,重点不在“考分”,而在“比理解深度、学实践方法”。“比”的是大家能否把条款和实际工作结合——比如,进入洁净区时,是否能想起无菌附录的要求;中药生产时,是否能对标生产管理规定的标准;承接受托任务时,是否明确自身的责任边界。“学”的是如何将这三份文件的要求,转化为日常工作的“自觉行动”,而不是死记硬背文字。希望大家把考试当成一次“全面查漏”:如果对某个流程不熟悉、对某个责任不明确,正好借这个机会补短板;更要记住,考试结束不是学习的终点,而是我们用标准规范工作、用责任守护质量的新起点。
考场上,公司总经理张德柱说,这场考试,考的是专业知识,更是我们对产品的责任心。祝愿每一位同事都能发挥真实水平,更能通过这次“比学”,把无菌意识、中药匠心、受托责任刻进心里、落到实处。
质量在我心,标准在我脑,工艺在我手,专业出成效。
匠心筑品质 共绘质量梦——朗天药业(湖北)有限公司举行比学考试系列活动纪实
9月10日,恰逢中国教师节,朗天药业(湖北)有限公司举行了一场涉及全员的“专业大考”——覆盖GMP无菌附录、中药生产管理规定、受托生产管理规定等等的全员比学考试。
这场考试不是一次简单的“答题测验”,而是我们守护产品质量、守住行业底线的“能力校准”。
“无菌”是药品安全的底线,“中药生产”则承载着传统技艺的传承与现代标准的融合。无菌附录里,从洁净区穿戴规范到设备消毒流程,每一条都是规避污染风险的“硬要求”。
中药生产管理规定中,从中药材源头鉴别,到成品质量检验,每一步都是守护中药“疗效”与“安全”的关键。
随着公司的业务发展,受托生产成为我们生产链条的重要组成部分。作为受托方,我们承接的不仅是生产任务,更是委托方的信任与产品的质量责任。这份规定清晰界定了我们的职责:从生产前的文件审核、物料管理,到生产中的过程控制、偏差处理,再到生产后的成品交付、记录留存,每一个环节都要“按规操作、有据可查”。“受托”不是“简单代工”,而是要以更高的标准、更严的要求。 我们既要用无菌标准守住“安全底线”,也要以中药生产规范传承“品质匠心”,更要把委托方的质量需求落到实处。
这次“比学考试”,重点不在“考分”,而在“比理解深度、学实践方法”。“比”的是大家能否把条款和实际工作结合——比如,进入洁净区时,是否能想起无菌附录的要求;中药生产时,是否能对标生产管理规定的标准;承接受托任务时,是否明确自身的责任边界。“学”的是如何将这三份文件的要求,转化为日常工作的“自觉行动”,而不是死记硬背文字。希望大家把考试当成一次“全面查漏”:如果对某个流程不熟悉、对某个责任不明确,正好借这个机会补短板;更要记住,考试结束不是学习的终点,而是我们用标准规范工作、用责任守护质量的新起点。
考场上,公司总经理张德柱说,这场考试,考的是专业知识,更是我们对产品的责任心。祝愿每一位同事都能发挥真实水平,更能通过这次“比学”,把无菌意识、中药匠心、受托责任刻进心里、落到实处。
质量在我心,标准在我脑,工艺在我手,专业出成效。
 乌兹别克斯坦共和国制药工业发展局主席一行考察朗天药业
8月12日午时,初秋时节,阳光明媚,彩旗飘扬,锣鼓喧天,狮子欢跳,朗天药业迎来了乌兹别克斯坦共和国制药工业发展局主席、卫生部第一副部长阿卜杜拉·阿齐佐夫先生一行到访,双方就药品国际贸易、医药产业投资等议题展开深入交流,达成初步共识。
图为:阿齐佐夫主席了解公司药品“回生再造丸”
图为:会谈现场,阿齐佐夫主席(中)
座谈会上,集团副总蔡和霖热情欢迎阿齐佐夫主席一行的到来。他介绍了朗天公司20年来秉承“以科技为先导、以质量求发展”的企业理念,实现了高品质的新药研发与药品制造,在中国新特药领域处于领先地位。在国家“一带一路”的倡议下,在中乌两国决定发展新时代全天候全面战略伙伴关系的大背景下,朗天公司将以此次交流为契机,在平等、互信、互利、共赢的原则下,推进促进药品贸易,分享制药技术,推进医药产业合作等。
武汉狼烟科技有限公司董事长孙家元介绍了药品药械引入乌兹别克斯坦贸易的情况,取得了令人鼓舞的业绩。
图为:集团副总蔡和霖致辞
阿齐佐夫主席对朗天公司的热情接待表示衷心感谢!他介绍了乌兹别克斯坦的经济发展状况、制药行业布局以及政府激励政策,就塔什干制药园的现状和未来规划进行详细推介,表示中亚地区各个国家的医疗高度依赖进口,乌兹别克斯坦具有辐射中亚以及独联体市场的战略价值。他强调,乌兹别克斯坦将医药产业发展作为国家战略,正大力吸引外资入驻,提供包括税收减免、注册流程优化等支持,以形成本土化的产业制造能力,并与国际先进力量形成产业协同。他希望朗天公司,包括吸引中方的其它合作伙伴在医疗、卫生、保健、食品、制药等进行合作,辐射中亚,打开国际市场,也希望蔡总等高管尽快去乌兹别克斯坦进行考察,加快合作进展。
图为:阿齐佐夫主席致辞及介绍塔什干制药园
阿齐佐夫主席一行还实地考察了朗天公司现代化的滴丸车间,注射制剂二车间和丸剂车间,对朗天公司的制药技术、设施设备以及生产能力表示了高度赞赏。
图为:签约现场
双方就促进药品贸易和投资、合作开发药品、分享制药领域的研究、创新和技术等进行商谈,一致同意成立联合工作组,以促进相互业务协作。在与会人员的共同见证下,阿齐佐夫主席与蔡总正式签署《合作备忘录》。
武汉狼烟科技有限公司总经理朱新驰等,集团副总方贤贵、张显强、张德柱等参与交流活动。
乌兹别克斯坦共和国制药工业发展局主席一行考察朗天药业
8月12日午时,初秋时节,阳光明媚,彩旗飘扬,锣鼓喧天,狮子欢跳,朗天药业迎来了乌兹别克斯坦共和国制药工业发展局主席、卫生部第一副部长阿卜杜拉·阿齐佐夫先生一行到访,双方就药品国际贸易、医药产业投资等议题展开深入交流,达成初步共识。
图为:阿齐佐夫主席了解公司药品“回生再造丸”
图为:会谈现场,阿齐佐夫主席(中)
座谈会上,集团副总蔡和霖热情欢迎阿齐佐夫主席一行的到来。他介绍了朗天公司20年来秉承“以科技为先导、以质量求发展”的企业理念,实现了高品质的新药研发与药品制造,在中国新特药领域处于领先地位。在国家“一带一路”的倡议下,在中乌两国决定发展新时代全天候全面战略伙伴关系的大背景下,朗天公司将以此次交流为契机,在平等、互信、互利、共赢的原则下,推进促进药品贸易,分享制药技术,推进医药产业合作等。
武汉狼烟科技有限公司董事长孙家元介绍了药品药械引入乌兹别克斯坦贸易的情况,取得了令人鼓舞的业绩。
图为:集团副总蔡和霖致辞
阿齐佐夫主席对朗天公司的热情接待表示衷心感谢!他介绍了乌兹别克斯坦的经济发展状况、制药行业布局以及政府激励政策,就塔什干制药园的现状和未来规划进行详细推介,表示中亚地区各个国家的医疗高度依赖进口,乌兹别克斯坦具有辐射中亚以及独联体市场的战略价值。他强调,乌兹别克斯坦将医药产业发展作为国家战略,正大力吸引外资入驻,提供包括税收减免、注册流程优化等支持,以形成本土化的产业制造能力,并与国际先进力量形成产业协同。他希望朗天公司,包括吸引中方的其它合作伙伴在医疗、卫生、保健、食品、制药等进行合作,辐射中亚,打开国际市场,也希望蔡总等高管尽快去乌兹别克斯坦进行考察,加快合作进展。
图为:阿齐佐夫主席致辞及介绍塔什干制药园
阿齐佐夫主席一行还实地考察了朗天公司现代化的滴丸车间,注射制剂二车间和丸剂车间,对朗天公司的制药技术、设施设备以及生产能力表示了高度赞赏。
图为:签约现场
双方就促进药品贸易和投资、合作开发药品、分享制药领域的研究、创新和技术等进行商谈,一致同意成立联合工作组,以促进相互业务协作。在与会人员的共同见证下,阿齐佐夫主席与蔡总正式签署《合作备忘录》。
武汉狼烟科技有限公司总经理朱新驰等,集团副总方贤贵、张显强、张德柱等参与交流活动。
 喜报:朗天药业化药注射剂及吸入制剂创新药物智能化中试平台入围省级培育名单
近日,朗天药业化药注射剂及吸入制剂创新药物智能化中试平台成功入围 2025湖北省级制造业中试平台培育名单(鄂经信科技函〔2025】204号)。这一成果不仅彰显了朗天药业在医药研发领域的实力,更以扎实的产业转化成效,为黄石地区医药产业的创新发展注入了强大动力。
作为医药行业的重要参与者,朗天药业始终聚焦化药注射剂及吸入制剂创新药物的研发与生产,而此次入围的智能化中试平台正是我们产业布局的核心载体。该平台整合了先进的生产技术与智能化管理系统,构建起从实验室研究到大规模生产的高效过渡通道,显著提升了创新药物的研发效率和质量稳定性。
值得关注的是,该平台已展现出强劲的产业服务能力:成功承接 20 余家持有人的产品中试生产任务,在助力行业伙伴加速成果转化方面成效显著。同时,依托平台的技术支撑,朗天药业和持有人已取得6 个注射剂产品生产批件和2 个吸入制剂产品生产批件,充分验证了平台在合规化生产与产业化落地中的成熟度。更令人振奋的是,一款吸入制剂创新药已通过该平台完成临床样品生产,即将进入 2 期临床阶段,为广大患者带来新的治疗希望。
该中试平台的建设,是朗天药业构建 “研发-中试-产业化” 完整创新链条的关键一步。通过与上下游企业的紧密协同,如与原料药企业的深度合作,实现了产业链价值的最大化。此次入围省级培育名单,意味着平台将获得更多政策支持与资源倾斜,有望在智能化升级、技术创新等方面实现新突破。这不仅将助力朗天药业进一步提升核心竞争力,更将通过技术辐射与产业带动,对黄石地区乃至全省的医药产业高质量发展产生深远的示范效应。
未来,朗天药业将以此次入围为契机,持续加大研发投入,优化中试平台的运营管理,力争推动更多创新药物从实验室走向临床,惠及患者,为我省医药产业的创新发展贡献坚实力量。
喜报:朗天药业化药注射剂及吸入制剂创新药物智能化中试平台入围省级培育名单
近日,朗天药业化药注射剂及吸入制剂创新药物智能化中试平台成功入围 2025湖北省级制造业中试平台培育名单(鄂经信科技函〔2025】204号)。这一成果不仅彰显了朗天药业在医药研发领域的实力,更以扎实的产业转化成效,为黄石地区医药产业的创新发展注入了强大动力。
作为医药行业的重要参与者,朗天药业始终聚焦化药注射剂及吸入制剂创新药物的研发与生产,而此次入围的智能化中试平台正是我们产业布局的核心载体。该平台整合了先进的生产技术与智能化管理系统,构建起从实验室研究到大规模生产的高效过渡通道,显著提升了创新药物的研发效率和质量稳定性。
值得关注的是,该平台已展现出强劲的产业服务能力:成功承接 20 余家持有人的产品中试生产任务,在助力行业伙伴加速成果转化方面成效显著。同时,依托平台的技术支撑,朗天药业和持有人已取得6 个注射剂产品生产批件和2 个吸入制剂产品生产批件,充分验证了平台在合规化生产与产业化落地中的成熟度。更令人振奋的是,一款吸入制剂创新药已通过该平台完成临床样品生产,即将进入 2 期临床阶段,为广大患者带来新的治疗希望。
该中试平台的建设,是朗天药业构建 “研发-中试-产业化” 完整创新链条的关键一步。通过与上下游企业的紧密协同,如与原料药企业的深度合作,实现了产业链价值的最大化。此次入围省级培育名单,意味着平台将获得更多政策支持与资源倾斜,有望在智能化升级、技术创新等方面实现新突破。这不仅将助力朗天药业进一步提升核心竞争力,更将通过技术辐射与产业带动,对黄石地区乃至全省的医药产业高质量发展产生深远的示范效应。
未来,朗天药业将以此次入围为契机,持续加大研发投入,优化中试平台的运营管理,力争推动更多创新药物从实验室走向临床,惠及患者,为我省医药产业的创新发展贡献坚实力量。


- 12-19 2025
- 朗天药业荣获湖北省制造业单项冠军企业 近日,由湖北省经济与信息化厅主办的2025年全省制造业优质企业与基金供需对接暨制造业单项冠军企业培育活动在咸宁举办。朗天药业(湖北)有限公司被授予“湖北省制造业单项冠军企业(血塞通滴丸)”。 公司核心产品“血塞通滴丸”为创新剂型,所用药材三七来自云南文山道地药材,采用现代提取分离技术,摒弃药材中无效杂质;建立指纹图谱质控体系,确保批次间质量一致性;借助于载体以细微晶体或分子状态分散于水中,使得药物溶出速率加快。拥有以下显著优势:(1)每丸重28mg,含三七总皂苷10mg,纯度高、辅料少,具有更高的生物利用度;(2)可吞服,可含服,崩解时间短,起效快,依从性好,安全性优;(3)体积远小于其他口服剂型,更适合心脑血管伴吞咽困难的患者;(4)具有活血祛瘀,通脉活络的功效,广泛用于脑络瘀阻所致中风偏瘫,心脉瘀阻所致胸痹心痛,脑血管后遗症,冠心病心绞痛等疾病的治疗;(5)医院覆盖率最高,覆盖全国31个省市,二级以上医院4200余家、基层医疗机构50000余家。血塞通滴丸临床价值显著,用药安全,为广大心脑血管疾病患者提供更优质的用药选择。 朗天药业是朗天医药集团旗下集药品研发、生产和销售于一体的国家高新技术企业,拥有智能化冻干粉针剂、小容量注射剂、雾化吸入溶液和中药滴丸、丸剂生产线,其中智能化滴丸生产线填补湖北省在该领域的空白,是“湖北省工业质量标杆企业”和“湖北省金种子企业”。公司将以“湖北省制造业单项冠军企业”这一殊荣为契机,在心脑血管细分领域进一步深耕细作,为我国心脑血管疾病防治事业贡献更好的力量。
- 11-21 2025
- “仿创结合、中西并举”驱动增长,朗天医药集团亮相第91届药交会 11月19日,第91届全国药品交易会在南京国际博览中心隆重开幕,作为中国乃至全球医药领域的盛会,本届药交会以“构建医药健康创新共融新生态”为主题,展览规模达10万平米,吸引国内外2000多家企业参展,预计参展人数将突破10万人次。 图为:开幕式盛况 图为:朗天医药集团展台 朗天医药集团在9号馆门口精彩亮相,展区内血塞通滴丸(集采中选)、回生再造丸(经典名方)、咽喉消炎丸以及最新上市的盐酸甲氧氯普胺注射液(集采中选)、注射用尼可地尔、帕拉米韦注射液等产品琳琅满目,展现了企业在中药传承与化药创新的活力。 展会期间,董事长蔡翔率公司高管亲临展台,会见了多家重要合作伙伴及潜在客户,深入交流,分析趋势,展望愿景。集团展台人流如织,气氛热烈,参展团队与各地客商介绍产品,洽谈意向。 图为:蔡翔董事长与医药同仁交流中 朗天集团的血塞通滴丸以精选的三七剪口入药,高浓缩工艺,凭借卓越品质,再次中选全国中成药采购联盟集中采购,在全国各等级及基层医疗机构得到了广泛使用,在治疗心脑血管疾病方面受到良好反馈,彰显了企业在产品质量和信誉方面的综合实力,成为展会的亮点之一。 图为:展区现场客户交流 本届展会进一步提升了集团品牌形象。集团将开拓更多新品,提升服务品质,深化伙伴关系,实现合作共赢,为推动中国大健康医药产业的发展贡献力量。
- 09-10 2025
- 匠心筑品质 共绘质量梦——朗天药业(湖北)有限公司举行比学考试系列活动纪实 9月10日,恰逢中国教师节,朗天药业(湖北)有限公司举行了一场涉及全员的“专业大考”——覆盖GMP无菌附录、中药生产管理规定、受托生产管理规定等等的全员比学考试。 这场考试不是一次简单的“答题测验”,而是我们守护产品质量、守住行业底线的“能力校准”。 “无菌”是药品安全的底线,“中药生产”则承载着传统技艺的传承与现代标准的融合。无菌附录里,从洁净区穿戴规范到设备消毒流程,每一条都是规避污染风险的“硬要求”。 中药生产管理规定中,从中药材源头鉴别,到成品质量检验,每一步都是守护中药“疗效”与“安全”的关键。 随着公司的业务发展,受托生产成为我们生产链条的重要组成部分。作为受托方,我们承接的不仅是生产任务,更是委托方的信任与产品的质量责任。这份规定清晰界定了我们的职责:从生产前的文件审核、物料管理,到生产中的过程控制、偏差处理,再到生产后的成品交付、记录留存,每一个环节都要“按规操作、有据可查”。“受托”不是“简单代工”,而是要以更高的标准、更严的要求。 我们既要用无菌标准守住“安全底线”,也要以中药生产规范传承“品质匠心”,更要把委托方的质量需求落到实处。 这次“比学考试”,重点不在“考分”,而在“比理解深度、学实践方法”。“比”的是大家能否把条款和实际工作结合——比如,进入洁净区时,是否能想起无菌附录的要求;中药生产时,是否能对标生产管理规定的标准;承接受托任务时,是否明确自身的责任边界。“学”的是如何将这三份文件的要求,转化为日常工作的“自觉行动”,而不是死记硬背文字。希望大家把考试当成一次“全面查漏”:如果对某个流程不熟悉、对某个责任不明确,正好借这个机会补短板;更要记住,考试结束不是学习的终点,而是我们用标准规范工作、用责任守护质量的新起点。 考场上,公司总经理张德柱说,这场考试,考的是专业知识,更是我们对产品的责任心。祝愿每一位同事都能发挥真实水平,更能通过这次“比学”,把无菌意识、中药匠心、受托责任刻进心里、落到实处。 质量在我心,标准在我脑,工艺在我手,专业出成效。
- 08-14 2025
- 乌兹别克斯坦共和国制药工业发展局主席一行考察朗天药业 8月12日午时,初秋时节,阳光明媚,彩旗飘扬,锣鼓喧天,狮子欢跳,朗天药业迎来了乌兹别克斯坦共和国制药工业发展局主席、卫生部第一副部长阿卜杜拉·阿齐佐夫先生一行到访,双方就药品国际贸易、医药产业投资等议题展开深入交流,达成初步共识。 图为:阿齐佐夫主席了解公司药品“回生再造丸” 图为:会谈现场,阿齐佐夫主席(中) 座谈会上,集团副总蔡和霖热情欢迎阿齐佐夫主席一行的到来。他介绍了朗天公司20年来秉承“以科技为先导、以质量求发展”的企业理念,实现了高品质的新药研发与药品制造,在中国新特药领域处于领先地位。在国家“一带一路”的倡议下,在中乌两国决定发展新时代全天候全面战略伙伴关系的大背景下,朗天公司将以此次交流为契机,在平等、互信、互利、共赢的原则下,推进促进药品贸易,分享制药技术,推进医药产业合作等。 武汉狼烟科技有限公司董事长孙家元介绍了药品药械引入乌兹别克斯坦贸易的情况,取得了令人鼓舞的业绩。 图为:集团副总蔡和霖致辞 阿齐佐夫主席对朗天公司的热情接待表示衷心感谢!他介绍了乌兹别克斯坦的经济发展状况、制药行业布局以及政府激励政策,就塔什干制药园的现状和未来规划进行详细推介,表示中亚地区各个国家的医疗高度依赖进口,乌兹别克斯坦具有辐射中亚以及独联体市场的战略价值。他强调,乌兹别克斯坦将医药产业发展作为国家战略,正大力吸引外资入驻,提供包括税收减免、注册流程优化等支持,以形成本土化的产业制造能力,并与国际先进力量形成产业协同。他希望朗天公司,包括吸引中方的其它合作伙伴在医疗、卫生、保健、食品、制药等进行合作,辐射中亚,打开国际市场,也希望蔡总等高管尽快去乌兹别克斯坦进行考察,加快合作进展。 图为:阿齐佐夫主席致辞及介绍塔什干制药园 阿齐佐夫主席一行还实地考察了朗天公司现代化的滴丸车间,注射制剂二车间和丸剂车间,对朗天公司的制药技术、设施设备以及生产能力表示了高度赞赏。 图为:签约现场 双方就促进药品贸易和投资、合作开发药品、分享制药领域的研究、创新和技术等进行商谈,一致同意成立联合工作组,以促进相互业务协作。在与会人员的共同见证下,阿齐佐夫主席与蔡总正式签署《合作备忘录》。 武汉狼烟科技有限公司总经理朱新驰等,集团副总方贤贵、张显强、张德柱等参与交流活动。
- 08-07 2025
- 喜报:朗天药业化药注射剂及吸入制剂创新药物智能化中试平台入围省级培育名单 近日,朗天药业化药注射剂及吸入制剂创新药物智能化中试平台成功入围 2025湖北省级制造业中试平台培育名单(鄂经信科技函〔2025】204号)。这一成果不仅彰显了朗天药业在医药研发领域的实力,更以扎实的产业转化成效,为黄石地区医药产业的创新发展注入了强大动力。 作为医药行业的重要参与者,朗天药业始终聚焦化药注射剂及吸入制剂创新药物的研发与生产,而此次入围的智能化中试平台正是我们产业布局的核心载体。该平台整合了先进的生产技术与智能化管理系统,构建起从实验室研究到大规模生产的高效过渡通道,显著提升了创新药物的研发效率和质量稳定性。 值得关注的是,该平台已展现出强劲的产业服务能力:成功承接 20 余家持有人的产品中试生产任务,在助力行业伙伴加速成果转化方面成效显著。同时,依托平台的技术支撑,朗天药业和持有人已取得6 个注射剂产品生产批件和2 个吸入制剂产品生产批件,充分验证了平台在合规化生产与产业化落地中的成熟度。更令人振奋的是,一款吸入制剂创新药已通过该平台完成临床样品生产,即将进入 2 期临床阶段,为广大患者带来新的治疗希望。 该中试平台的建设,是朗天药业构建 “研发-中试-产业化” 完整创新链条的关键一步。通过与上下游企业的紧密协同,如与原料药企业的深度合作,实现了产业链价值的最大化。此次入围省级培育名单,意味着平台将获得更多政策支持与资源倾斜,有望在智能化升级、技术创新等方面实现新突破。这不仅将助力朗天药业进一步提升核心竞争力,更将通过技术辐射与产业带动,对黄石地区乃至全省的医药产业高质量发展产生深远的示范效应。 未来,朗天药业将以此次入围为契机,持续加大研发投入,优化中试平台的运营管理,力争推动更多创新药物从实验室走向临床,惠及患者,为我省医药产业的创新发展贡献坚实力量。
 国内空白,又一款抗失眠新药首仿来袭|非特殊管制+非成瘾
依据中国睡眠研究会《2025年中国睡眠健康调查报告》,中国18岁及以上人群中,高达48.5%存在睡眠困扰,主要症状表现为入睡困难、夜间易醒及早醒等。随着年龄增长,睡眠困扰率呈现递增趋势,65岁及以上人群睡眠困扰率最高,达73.7%。
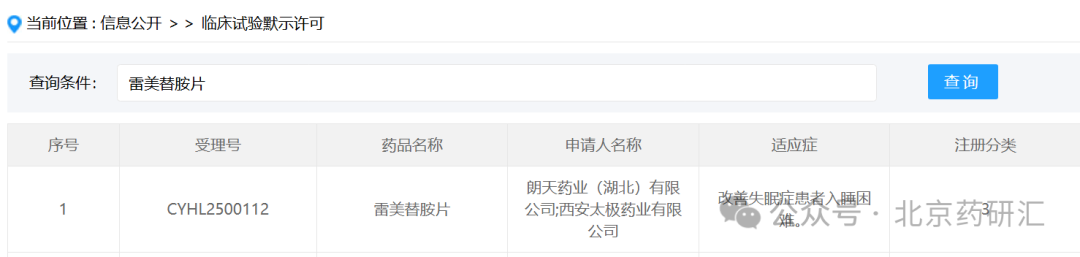
近日,2025年8月18日,根据中国国家药品审评中心(CDE)官网最新公示,朗天药业(湖北)有限公司按化药注册分类3类申报的雷美替胺片临床申请获默示许可。公开资料显示,雷美替胺(ramelteon)是一种选择性褪黑素受体激动剂,主要用于改善失眠症患者入睡困难。
雷美替胺一种褪黑激素受体激动剂,对于褪黑激素MT1和MT2都具有较高的亲和性,被认为具有促进睡眠的性质。通过激活大脑中的MT1和MT2受体,调节睡眠-觉醒周期,帮助改善入睡困难,且不显著影响正常睡眠结构。褪黑素是一种诱导自然睡眠的体内激素,它通过调节人的自然睡眠而克服睡眠障碍,提高睡眠质量。它与其他安眠药的最大区别在于,褪黑素无成瘾性,无明显副作用。
值得一提的是,雷美替胺是首个和迄今唯一无滥用和依赖性的失眠处方治疗药,也是第一个应用于临床治疗失眠的褪黑素受体激动剂,用于治疗以入睡困难为特征的失眠症。该原研药(商品名:Rozerem)是由日本武田公司研发,于2005年7月22日率先在美国上市,2008年在日本上市。
截至目前为止,雷美替胺片原研药尚未在国内上市,据CDE官网查询最新显示,国内已有南京正大天晴制药有限公司、四川科瑞德制药股份有限公司、朗天药业(湖北)有限公司3家药企提交了雷美替胺片临床申请,均获受理,目前处于临床阶段。
雷美替胺片作为一种治疗失眠的药物,尤其针对入睡困难型失眠症,因其独特的作用机制和安全性,具有一定的临床优势。
一、独特的作用机制
雷美替胺是首个应用于临床治疗失眠的褪黑素受体激动剂,它是一种选择性褪黑素受体激动剂,主要针对大脑中的MT1和MT2受体。这类似于你体内天然的褪黑素,但作用更精准强力。通过激活这些受体,它帮助调节你的睡眠-觉醒周期,更接近于生理性的睡眠诱导过程,这不同于传统安眠药通过抑制中枢神经系统来促眠的方式。用法简便:雷美替胺片的用法是每日一次,每次8mg,睡前30分钟内服用。需要注意的是,应避免与高脂肪餐同服,因为高脂肪餐可能会延迟药物的达峰时间。
二、较高的安全性
无成瘾性和依赖性:雷美替胺是首个和迄今唯一无滥用和依赖性的失眠处方治疗药。即使超剂量(20倍推荐量)亦未发现滥用倾向,无躯体依赖性证据。
不影响正常睡眠结构:它主要帮助你缩短入睡时间,不显著影响正常睡眠结构。
次日残留效应小:由于其半衰期短(原型药半衰期1-2.6小时,主要活性代谢物M-II半衰期2-5小时),并且每天服用未观察到蓄积,因此第二天通常不会感到昏昏沉沉的“宿醉感”。
常见不良反应相对较轻:虽然也可能有副作用,但常见的如嗜睡、头晕、乏力、恶心等通常程度较轻。当然,像任何药物一样,它也需要注意一些潜在的严重但罕见的不良反应,例如复杂睡眠行为(如梦游)、过敏反应等。
三、适用的患者人群
雷美替胺对于入睡困难为主的失眠患者效果较好。一些特殊人群用药也提供了参考:
老年人:75岁或以上老人和年轻成年受试者之间没有观察到安全性或有效性的总体差异。
肝功能不全患者:中度肝功能不全患者应慎用,严重肝功能不全患者则不建议使用。轻度肝功能损害受试者对雷美替胺的暴露增加四倍,中度肝功能损害受试者暴露于雷美替胺增加十倍以上。
肾功能不全患者:研究显示,肾功能不全患者服用雷美替胺后,其原型药物及代谢产物的峰浓度和血药浓度-时间曲线下面积均未受影响,因此肾功能不全患者无需调整雷美替胺用药剂量。
雷美替胺片为入睡困难型失眠症患者提供了一个具有独特作用机制、无成瘾性、整体安全性良好、更接近生理睡眠模式的治疗选择,特别适合那些关注药物依赖风险、希望避免次日嗜睡感的患者。尤其适合需要长期用药的患者以及对苯二氮䓬类药物成瘾风险有所顾虑的患者。随着国内药企对雷美替胺片仿制药的布局,将为广大入睡困难型失眠症患者提供新的治疗选择。
国内空白,又一款抗失眠新药首仿来袭|非特殊管制+非成瘾
依据中国睡眠研究会《2025年中国睡眠健康调查报告》,中国18岁及以上人群中,高达48.5%存在睡眠困扰,主要症状表现为入睡困难、夜间易醒及早醒等。随着年龄增长,睡眠困扰率呈现递增趋势,65岁及以上人群睡眠困扰率最高,达73.7%。
近日,2025年8月18日,根据中国国家药品审评中心(CDE)官网最新公示,朗天药业(湖北)有限公司按化药注册分类3类申报的雷美替胺片临床申请获默示许可。公开资料显示,雷美替胺(ramelteon)是一种选择性褪黑素受体激动剂,主要用于改善失眠症患者入睡困难。
雷美替胺一种褪黑激素受体激动剂,对于褪黑激素MT1和MT2都具有较高的亲和性,被认为具有促进睡眠的性质。通过激活大脑中的MT1和MT2受体,调节睡眠-觉醒周期,帮助改善入睡困难,且不显著影响正常睡眠结构。褪黑素是一种诱导自然睡眠的体内激素,它通过调节人的自然睡眠而克服睡眠障碍,提高睡眠质量。它与其他安眠药的最大区别在于,褪黑素无成瘾性,无明显副作用。
值得一提的是,雷美替胺是首个和迄今唯一无滥用和依赖性的失眠处方治疗药,也是第一个应用于临床治疗失眠的褪黑素受体激动剂,用于治疗以入睡困难为特征的失眠症。该原研药(商品名:Rozerem)是由日本武田公司研发,于2005年7月22日率先在美国上市,2008年在日本上市。
截至目前为止,雷美替胺片原研药尚未在国内上市,据CDE官网查询最新显示,国内已有南京正大天晴制药有限公司、四川科瑞德制药股份有限公司、朗天药业(湖北)有限公司3家药企提交了雷美替胺片临床申请,均获受理,目前处于临床阶段。
雷美替胺片作为一种治疗失眠的药物,尤其针对入睡困难型失眠症,因其独特的作用机制和安全性,具有一定的临床优势。
一、独特的作用机制
雷美替胺是首个应用于临床治疗失眠的褪黑素受体激动剂,它是一种选择性褪黑素受体激动剂,主要针对大脑中的MT1和MT2受体。这类似于你体内天然的褪黑素,但作用更精准强力。通过激活这些受体,它帮助调节你的睡眠-觉醒周期,更接近于生理性的睡眠诱导过程,这不同于传统安眠药通过抑制中枢神经系统来促眠的方式。用法简便:雷美替胺片的用法是每日一次,每次8mg,睡前30分钟内服用。需要注意的是,应避免与高脂肪餐同服,因为高脂肪餐可能会延迟药物的达峰时间。
二、较高的安全性
无成瘾性和依赖性:雷美替胺是首个和迄今唯一无滥用和依赖性的失眠处方治疗药。即使超剂量(20倍推荐量)亦未发现滥用倾向,无躯体依赖性证据。
不影响正常睡眠结构:它主要帮助你缩短入睡时间,不显著影响正常睡眠结构。
次日残留效应小:由于其半衰期短(原型药半衰期1-2.6小时,主要活性代谢物M-II半衰期2-5小时),并且每天服用未观察到蓄积,因此第二天通常不会感到昏昏沉沉的“宿醉感”。
常见不良反应相对较轻:虽然也可能有副作用,但常见的如嗜睡、头晕、乏力、恶心等通常程度较轻。当然,像任何药物一样,它也需要注意一些潜在的严重但罕见的不良反应,例如复杂睡眠行为(如梦游)、过敏反应等。
三、适用的患者人群
雷美替胺对于入睡困难为主的失眠患者效果较好。一些特殊人群用药也提供了参考:
老年人:75岁或以上老人和年轻成年受试者之间没有观察到安全性或有效性的总体差异。
肝功能不全患者:中度肝功能不全患者应慎用,严重肝功能不全患者则不建议使用。轻度肝功能损害受试者对雷美替胺的暴露增加四倍,中度肝功能损害受试者暴露于雷美替胺增加十倍以上。
肾功能不全患者:研究显示,肾功能不全患者服用雷美替胺后,其原型药物及代谢产物的峰浓度和血药浓度-时间曲线下面积均未受影响,因此肾功能不全患者无需调整雷美替胺用药剂量。
雷美替胺片为入睡困难型失眠症患者提供了一个具有独特作用机制、无成瘾性、整体安全性良好、更接近生理睡眠模式的治疗选择,特别适合那些关注药物依赖风险、希望避免次日嗜睡感的患者。尤其适合需要长期用药的患者以及对苯二氮䓬类药物成瘾风险有所顾虑的患者。随着国内药企对雷美替胺片仿制药的布局,将为广大入睡困难型失眠症患者提供新的治疗选择。
 朗天医药帕拉米韦吸入溶液启动II期临床 适应症为甲型或乙型流行性感冒
药物临床试验登记与信息公示平台数据显示,朗天医药科技(武汉)有限公司/朗天药业(湖北)有限公司的初步评价帕拉米韦吸入溶液治疗成人无并发症的单纯性流感的有效性及安全性的多中心、随机、双盲、安慰剂对照的Ⅱ期临床研究已启动。临床试验登记号为CTR20252729,首次公示信息日期为2025年7月22日。
该药物剂型为吸入制剂,用法用量为60mg(2ml:20mg,1支 + 2ml:40mg,1支)多次给药组三天每次分别为“1支2ml:20mg + 1支2ml:40mg”;80mg(2ml:40mg,2支)多次给药组三天每次分别为“2支2ml:40mg”;80mg(2ml:40mg,2支)单次给药组每次2ml:40mg,2支,用药时程为3天为一个吸入给药周期,共吸入给药一个周期。本次试验目的是考察不同剂量帕拉米韦吸入溶液对比安慰剂治疗成人无并发症的单纯性流感的安全性及有效性,为疗效确证阶段给药方案的确定提供依据。
帕拉米韦吸入溶液为化学药物,适应症为甲型或乙型流行性感冒。流感是流感病毒引起的急性呼吸道传染病,症状有高热、乏力、头痛、咳嗽等。通过症状、流感抗原检测等诊断,治疗可用抗病毒药物。
本次试验主要终点指标包括流感病毒转阴的时间(单位:小时),定义为从开始研究治疗至首次流感病毒RNA低于最低检测限的时间【通过定量PCR方法进行测定】;次要终点指标包括流感病毒转阴时间、病毒RNA及滴度变化、病毒载量AUC等多项有效性指标,以及不良事件等安全性指标。
目前,该实验状态为进行中(尚未招募),目标入组人数240人。
朗天医药帕拉米韦吸入溶液启动II期临床 适应症为甲型或乙型流行性感冒
药物临床试验登记与信息公示平台数据显示,朗天医药科技(武汉)有限公司/朗天药业(湖北)有限公司的初步评价帕拉米韦吸入溶液治疗成人无并发症的单纯性流感的有效性及安全性的多中心、随机、双盲、安慰剂对照的Ⅱ期临床研究已启动。临床试验登记号为CTR20252729,首次公示信息日期为2025年7月22日。
该药物剂型为吸入制剂,用法用量为60mg(2ml:20mg,1支 + 2ml:40mg,1支)多次给药组三天每次分别为“1支2ml:20mg + 1支2ml:40mg”;80mg(2ml:40mg,2支)多次给药组三天每次分别为“2支2ml:40mg”;80mg(2ml:40mg,2支)单次给药组每次2ml:40mg,2支,用药时程为3天为一个吸入给药周期,共吸入给药一个周期。本次试验目的是考察不同剂量帕拉米韦吸入溶液对比安慰剂治疗成人无并发症的单纯性流感的安全性及有效性,为疗效确证阶段给药方案的确定提供依据。
帕拉米韦吸入溶液为化学药物,适应症为甲型或乙型流行性感冒。流感是流感病毒引起的急性呼吸道传染病,症状有高热、乏力、头痛、咳嗽等。通过症状、流感抗原检测等诊断,治疗可用抗病毒药物。
本次试验主要终点指标包括流感病毒转阴的时间(单位:小时),定义为从开始研究治疗至首次流感病毒RNA低于最低检测限的时间【通过定量PCR方法进行测定】;次要终点指标包括流感病毒转阴时间、病毒RNA及滴度变化、病毒载量AUC等多项有效性指标,以及不良事件等安全性指标。
目前,该实验状态为进行中(尚未招募),目标入组人数240人。
 2025年医保目录调整工作启动
2025年07月22日 来源:中国医药报 记者 郭婷
近日,国家医保局发布《2025年国家基本医疗保险、生育保险和工伤保险药品目录及商业健康保险创新药品目录调整工作方案》(以下简称《工作方案》)等相关文件,启动2025年国家基本医疗保险、生育保险和工伤保险药品目录(以下简称基本目录)及商业健康保险创新药品目录(以下简称商保创新药目录)调整工作。《工作方案》释放出“真支持创新、支持真创新、支持差异化创新”的强烈信号,最大亮点当属将制定第一版商保创新药目录,为高值创新药支付提供新通道。
商保创新药目录是业界关注的焦点。根据《工作方案》,2025年将制定第一版商保创新药目录,主要聚焦创新程度高、临床价值大、患者获益显著,但因超出“保基本”定位暂时无法纳入基本目录的药品。在5年内批准上市的新通用名或治疗罕见病的独家药品可以申报。
数据显示,自2020年以来,截至今年上半年,共有210余个创新药获批上市。其中,有部分创新药上市多年,但因价格较高无法进入“保基本”的基本目录。例如,备受关注的CAR-T细胞治疗产品阿基仑赛注射液、瑞基奥仑赛注射液,ADC药物注射用德曲妥珠单抗等产品因价格高昂,多次冲刺基本目录未果。商保创新药目录为这类高值创新药提供了一个新通道。
与基本目录价格谈判不同,商保创新药目录通过协商确定价格,商保专家对药品是否能够进入商保创新药目录以及是否能够进行价格协商具有重要决策权。根据《工作方案》,在价格谈判/协商阶段(2025年9月—10月),组织企业进行现场价格协商,协商成功的药品纳入商保创新药目录,并签署协议;经专家评审建议既可以调入基本目录也可以调入商保创新药目录的药品,应先开展基本目录谈判,谈判失败的进入价格协商环节。
进入商保创新药目录的药品能享受哪些政策支持?国家医保局表示,将探索优化调整支付管理政策,对于商保创新药目录内药品给予“三除外”支持,即可不计入基本医保自费率指标,不纳入集采中选可替代品种监测的范围,符合条件的商业健康保险保障范围内的创新药应用病例可不纳入按病种付费范围,经审核评议程序后支付。
针对2025年国家医保基本目录调整,《工作方案》显示,将继续向罕见病、儿童用药倾斜。目录外新通用名药品、新适应证药品的申报仍以2020年1月1日至2025年6月30日期间划定界线,但纳入鼓励研发申报儿童药品清单或罕见病治疗药品,仅需满足在2025年6月30日前经国家药监部门批准上市即可。此外,坚持调进调出并重,建立目录内药品配备情况监测机制,对于临床价值不高且可被其他品种替代、长期未生产使用、无法保障有效供应的药品,重点考虑调出基本目录。 值得注意的是,《工作方案》还明确提出,在5年内批准上市的新通用名或治疗罕见病的独家药品,可以单独申报商保创新药目录或同时申报商保创新药目录、基本目录。
2025年医保目录调整工作启动
2025年07月22日 来源:中国医药报 记者 郭婷
近日,国家医保局发布《2025年国家基本医疗保险、生育保险和工伤保险药品目录及商业健康保险创新药品目录调整工作方案》(以下简称《工作方案》)等相关文件,启动2025年国家基本医疗保险、生育保险和工伤保险药品目录(以下简称基本目录)及商业健康保险创新药品目录(以下简称商保创新药目录)调整工作。《工作方案》释放出“真支持创新、支持真创新、支持差异化创新”的强烈信号,最大亮点当属将制定第一版商保创新药目录,为高值创新药支付提供新通道。
商保创新药目录是业界关注的焦点。根据《工作方案》,2025年将制定第一版商保创新药目录,主要聚焦创新程度高、临床价值大、患者获益显著,但因超出“保基本”定位暂时无法纳入基本目录的药品。在5年内批准上市的新通用名或治疗罕见病的独家药品可以申报。
数据显示,自2020年以来,截至今年上半年,共有210余个创新药获批上市。其中,有部分创新药上市多年,但因价格较高无法进入“保基本”的基本目录。例如,备受关注的CAR-T细胞治疗产品阿基仑赛注射液、瑞基奥仑赛注射液,ADC药物注射用德曲妥珠单抗等产品因价格高昂,多次冲刺基本目录未果。商保创新药目录为这类高值创新药提供了一个新通道。
与基本目录价格谈判不同,商保创新药目录通过协商确定价格,商保专家对药品是否能够进入商保创新药目录以及是否能够进行价格协商具有重要决策权。根据《工作方案》,在价格谈判/协商阶段(2025年9月—10月),组织企业进行现场价格协商,协商成功的药品纳入商保创新药目录,并签署协议;经专家评审建议既可以调入基本目录也可以调入商保创新药目录的药品,应先开展基本目录谈判,谈判失败的进入价格协商环节。
进入商保创新药目录的药品能享受哪些政策支持?国家医保局表示,将探索优化调整支付管理政策,对于商保创新药目录内药品给予“三除外”支持,即可不计入基本医保自费率指标,不纳入集采中选可替代品种监测的范围,符合条件的商业健康保险保障范围内的创新药应用病例可不纳入按病种付费范围,经审核评议程序后支付。
针对2025年国家医保基本目录调整,《工作方案》显示,将继续向罕见病、儿童用药倾斜。目录外新通用名药品、新适应证药品的申报仍以2020年1月1日至2025年6月30日期间划定界线,但纳入鼓励研发申报儿童药品清单或罕见病治疗药品,仅需满足在2025年6月30日前经国家药监部门批准上市即可。此外,坚持调进调出并重,建立目录内药品配备情况监测机制,对于临床价值不高且可被其他品种替代、长期未生产使用、无法保障有效供应的药品,重点考虑调出基本目录。 值得注意的是,《工作方案》还明确提出,在5年内批准上市的新通用名或治疗罕见病的独家药品,可以单独申报商保创新药目录或同时申报商保创新药目录、基本目录。
 解析DRG支付方式改革路径
“截至目前,全国393个统筹地区中实施按病组(DRG)付费191个、按病种分值(DIP)付费200个,天津与上海兼具两种付费模式,实现了统筹地区全覆盖、符合条件的医疗机构全覆盖、病种覆盖率达到95%、医保基金覆盖率达到80%。”4月18日,2025年医保支付方式改革蓝皮书发布会暨趋势交流会上,国家医保局医药服务管理司副司长徐娜介绍了当前医保支付改革取得的积极成效。
据悉,此前医保基金采取“按项目”付费的方式,虽然简单便捷,但容易诱发医疗费用过快增长、“过度医疗”屡禁不绝等问题,医务人员劳动价值也没有充分体现。而DRG/DIP付费则是通过对疾病诊疗分组或折算分值,进行“打包”付费,能够进一步规范诊疗行为。
历经多年探索,我国DRG改革形成了“顶层设计—试点先行—全国推广”的推进路径。从2019年整合国内主流分组版本推出1.0版方案,到2024年2.0版通过多学科联合论证、人工智能算法等数智技术实现分组科学性跃升,分组方案持续迭代优化,核心分组从376个增至409个,细分组从618个扩展至634个,精准匹配临床多学科诊疗趋势,回应“挑选病人”“机械控费”等改革痛点,改革成效惠及全国。
分组方案迭代至2.0:从无到优,破解支付改革痛点问题
分组方案是医保支付方式改革的重要支撑,政府工作报告提出要深化医保支付方式改革。支付方式改革使得全国大部分地区群众就诊经济负担显著下降、医保基金使用效率提升,但还是有少数医疗机构出现了临床“挑选病人”、医生“拿着计算器看病”等现象。为进一步深化改革、完善支付环节,我国推出了2.0版分组方案。
DRG分组方案是DRG付费理论和我国医疗保障实践相结合的成果,也是以我国医疗服务特点和医保实际费用数据为基础形成的,用于全国医保DRG付费的统一权威分组版本。
1.0版分组方案(2019):整合当时国内主流应用的四个DRG版本,广泛吸收了各个版本在各自领域的应用经验,设置了核心分组376个,细分组618个。
1.1版分组方案(2021):为充分分析数据规律,在临床专家论证的基础上,通过建立超算实验室,利用30个试点城市改革数据,分析年龄、离院方式、合并症并发症等因素对医疗资源消耗的影响,编制形成1.1版本,包含核心分组376个,细分组628个。
2.0版分组方案(2024):一方面,为进一步匹配临床实际情况,顺应临床由单科或全院会诊转向多学科诊疗模式的发展趋势,在单个学科独立论证的基础上,建立多专业联合论证模式,并重点考虑了联合手术、复合手术问题。另一方面,数智赋能方案更科学。
通过引入人工智能算法,从临床专业知识、数据编码规范、DRG技术评价等多目标维度建立遗传算法模型,编制分组方案,并应用麻醉风险分级对分组结果进行校验。该版本分组方案核心分组409个,细分组634个,有效回应了临床诉求,体现了“医保医疗相向而行、协同发展”的价值导向,同时,通过大数据赋能进一步提升了分组方案的科学性。
持续优化:构建四大机制,凝聚多学科共识赋能支付改革
一是组建技术专家团队。专家团队是推动DRG付费改革落地实施、行稳致远的重要保障。目前,技术指导组拥有400多人的专家团队,涵盖临床、统计、病案等多个专业,为核心分组论证、细分组统计分析、审核监管、数据监测提供强大的专业支持。以临床论证工作为例,技术工作组与中华医学会、中华口腔医学会保持了长期的密切合作,分学科组建了31个临床论证小组,汇聚了临床专家169人,并为各小组配备63名医保专家、33名编码专家,形成了由265人组成的临床专家团队。
二是建立意见收集机制。支付方式改革涉及多方利益,如果没有广泛的社会共识,改革就难以顺利进行。在分组方案编制过程中,技术指导组广泛收集医保行政和经办部门、行业协会、医疗机构以及医药产业的意见和建议,并对收集的近万条建议进行深入分析,在2.0版分组方案中采纳了合理化建议近8000条,充分凝聚了社会共识。
三是构建沟通协商机制。技术指导组高度重视与临床的沟通协商,核心分组编制工作依托中华医学会、中华口腔医学会,召开了36场专题临床论证会,共计700余名专家参与论证,2.0版分组方案充分凝聚了行业共识。
四是建立动态调整机制。技术指导组高度重视行业发展对分组方案的影响,密切关注临床技术发展和诊疗服务优化、医疗费用数据规律变化以及科技发展带来的技术手段升级,并依据上述情况的发展,动态调整分组方案。
改革成效显著:提质增效,赋能三医协同治理新图景
增强人民群众就医获得感。改革后医疗机构诊疗行为更加规范,次均费用降低,参保群众的就医费用负担不断减轻,时间和费用消耗指数下降,平均住院日缩短,节省了参保群众的就医费用和时间成本。例如,吉林省2024年上半年医疗总费用157.25亿,较2023年下降18.42%;次均住院费用9379.96元,较2023年下降16.16%。重庆市实施DRG实际付费后,规范了用药、检查、检验、诊治等医疗服务行为,患者自负费用下降了21.54%。贵州省六盘水市居民次均住院费用同比下降了2.1%,职工同比下降7.7%,人均自付费用同比下降1.1%。
推动医疗机构高质量发展。在DRG付费改革过程中,各地医疗机构主动配合改革、不断创新,在干中学,学中干,在病案管理结算清单的指控,规范临床路径、病历精准入组等方面取得巨大进步,取得了药耗成本和住院费用双下降,医院收治疑难重症水平不断提升,医疗机构收入结构明显改善的良好改革成效。
比如,浙江大学医学院附属妇产科医院在诊疗过程中,创新同种处方的药物管理收费模式,依据医嘱剂量与用药人数确定收费单位,兼顾临床需求与成本平衡,减少医保基金支出约2200万元,受益患者达22万人次;北京肿瘤医院从DRG手术病组的麻醉费用入手,实现多学科综合管理,促医疗机构内部管理机制完善;上海金山医院大数据赋能,精准聚焦关键病组和识别异动数据,实现了医保基金高效使用、医疗质量提升与资源动态平衡的“多方共赢”;北京协和医院基于DRG分组将炎症性肠病患者细分为不同组别,通过DRG指导下的医联体协作模式对患者进行精准分级诊疗。
推动三医协同治理。一是提高基金效率。通过DRG付费改革引导医疗机构规范诊疗、合理控制成本,提升医保基金使用效率。以北京市为例,实际付费医疗机构职工医保住院基金平均增长率为10%,比非实际付费医疗机构住院基金平均增长率低7个百分点。二是支持行业发展。各地在推进改革的同时,充分考虑以历史数据打包付费的影响,建立了特例单议,新药新技术除外支付等配套机制,促进临床技术进步,也进一步激发了医药产业的创新动力。
数智赋能:解锁未来DRG管理的制胜密码
随着DRG付费改革的深入推进,诊疗行为随之发生变化,数据规律展现出新的特征。在此背景下,以大数据赋能DRG管理成为必然选择。大数据技术不仅能够对海量医疗数据进行采集、清洗、转换和分析,实现对病例的自动分组和归类,计算出各DRG组的成本、费用、医保支付标准等指标,还能通过预测分析和趋势预警,提前发现潜在问题和风险,为医院和医保部门的决策提供前瞻性参考,助力医疗领域的可持续发展。
数智赋能分组方案编制
大数据+人工智能技术可深度挖掘医疗数据,依据疾病诊断、治疗方式及病情严重程度等因素,将病例精准划分至不同DRG组别,提升分组准确性,使医疗资源配置更加合理。通过构建全面、海量的医疗大数据模型,可以识别出病例特征对资源消耗的影响,按照“临床路径相似、资源消耗相近”的原则,形成核心分组结果建议,克服传统分组方案编制耗时耗力且易出错的问题。
数智赋能DRG审核及监管
通过建立“大数据模型+专家论证+人工智能算法”的模型,强化流程清单管理和专家审核口径管理,提升审核工作的效率和精准度,不断规范DRG付费医院行为,保障医保基金安全有效使用。利用人工智能与大数据技术,不仅能对历史数据进行深入分析,发现潜在的违规行为,还能自动检测重复报销、过度治疗和虚假报销等问题,有效提升医保监管系统的智能化水平。
数智赋能DRG费用预测
利用大数据技术进行DRG费用预测,可以更加精确地评估每个患者的医疗资源使用情况,预测医保基金的流动趋势,实现对医疗服务费用的合理控制,为决策者提供科学依据,帮助做出动态的资源调整。
解析DRG支付方式改革路径
“截至目前,全国393个统筹地区中实施按病组(DRG)付费191个、按病种分值(DIP)付费200个,天津与上海兼具两种付费模式,实现了统筹地区全覆盖、符合条件的医疗机构全覆盖、病种覆盖率达到95%、医保基金覆盖率达到80%。”4月18日,2025年医保支付方式改革蓝皮书发布会暨趋势交流会上,国家医保局医药服务管理司副司长徐娜介绍了当前医保支付改革取得的积极成效。
据悉,此前医保基金采取“按项目”付费的方式,虽然简单便捷,但容易诱发医疗费用过快增长、“过度医疗”屡禁不绝等问题,医务人员劳动价值也没有充分体现。而DRG/DIP付费则是通过对疾病诊疗分组或折算分值,进行“打包”付费,能够进一步规范诊疗行为。
历经多年探索,我国DRG改革形成了“顶层设计—试点先行—全国推广”的推进路径。从2019年整合国内主流分组版本推出1.0版方案,到2024年2.0版通过多学科联合论证、人工智能算法等数智技术实现分组科学性跃升,分组方案持续迭代优化,核心分组从376个增至409个,细分组从618个扩展至634个,精准匹配临床多学科诊疗趋势,回应“挑选病人”“机械控费”等改革痛点,改革成效惠及全国。
分组方案迭代至2.0:从无到优,破解支付改革痛点问题
分组方案是医保支付方式改革的重要支撑,政府工作报告提出要深化医保支付方式改革。支付方式改革使得全国大部分地区群众就诊经济负担显著下降、医保基金使用效率提升,但还是有少数医疗机构出现了临床“挑选病人”、医生“拿着计算器看病”等现象。为进一步深化改革、完善支付环节,我国推出了2.0版分组方案。
DRG分组方案是DRG付费理论和我国医疗保障实践相结合的成果,也是以我国医疗服务特点和医保实际费用数据为基础形成的,用于全国医保DRG付费的统一权威分组版本。
1.0版分组方案(2019):整合当时国内主流应用的四个DRG版本,广泛吸收了各个版本在各自领域的应用经验,设置了核心分组376个,细分组618个。
1.1版分组方案(2021):为充分分析数据规律,在临床专家论证的基础上,通过建立超算实验室,利用30个试点城市改革数据,分析年龄、离院方式、合并症并发症等因素对医疗资源消耗的影响,编制形成1.1版本,包含核心分组376个,细分组628个。
2.0版分组方案(2024):一方面,为进一步匹配临床实际情况,顺应临床由单科或全院会诊转向多学科诊疗模式的发展趋势,在单个学科独立论证的基础上,建立多专业联合论证模式,并重点考虑了联合手术、复合手术问题。另一方面,数智赋能方案更科学。
通过引入人工智能算法,从临床专业知识、数据编码规范、DRG技术评价等多目标维度建立遗传算法模型,编制分组方案,并应用麻醉风险分级对分组结果进行校验。该版本分组方案核心分组409个,细分组634个,有效回应了临床诉求,体现了“医保医疗相向而行、协同发展”的价值导向,同时,通过大数据赋能进一步提升了分组方案的科学性。
持续优化:构建四大机制,凝聚多学科共识赋能支付改革
一是组建技术专家团队。专家团队是推动DRG付费改革落地实施、行稳致远的重要保障。目前,技术指导组拥有400多人的专家团队,涵盖临床、统计、病案等多个专业,为核心分组论证、细分组统计分析、审核监管、数据监测提供强大的专业支持。以临床论证工作为例,技术工作组与中华医学会、中华口腔医学会保持了长期的密切合作,分学科组建了31个临床论证小组,汇聚了临床专家169人,并为各小组配备63名医保专家、33名编码专家,形成了由265人组成的临床专家团队。
二是建立意见收集机制。支付方式改革涉及多方利益,如果没有广泛的社会共识,改革就难以顺利进行。在分组方案编制过程中,技术指导组广泛收集医保行政和经办部门、行业协会、医疗机构以及医药产业的意见和建议,并对收集的近万条建议进行深入分析,在2.0版分组方案中采纳了合理化建议近8000条,充分凝聚了社会共识。
三是构建沟通协商机制。技术指导组高度重视与临床的沟通协商,核心分组编制工作依托中华医学会、中华口腔医学会,召开了36场专题临床论证会,共计700余名专家参与论证,2.0版分组方案充分凝聚了行业共识。
四是建立动态调整机制。技术指导组高度重视行业发展对分组方案的影响,密切关注临床技术发展和诊疗服务优化、医疗费用数据规律变化以及科技发展带来的技术手段升级,并依据上述情况的发展,动态调整分组方案。
改革成效显著:提质增效,赋能三医协同治理新图景
增强人民群众就医获得感。改革后医疗机构诊疗行为更加规范,次均费用降低,参保群众的就医费用负担不断减轻,时间和费用消耗指数下降,平均住院日缩短,节省了参保群众的就医费用和时间成本。例如,吉林省2024年上半年医疗总费用157.25亿,较2023年下降18.42%;次均住院费用9379.96元,较2023年下降16.16%。重庆市实施DRG实际付费后,规范了用药、检查、检验、诊治等医疗服务行为,患者自负费用下降了21.54%。贵州省六盘水市居民次均住院费用同比下降了2.1%,职工同比下降7.7%,人均自付费用同比下降1.1%。
推动医疗机构高质量发展。在DRG付费改革过程中,各地医疗机构主动配合改革、不断创新,在干中学,学中干,在病案管理结算清单的指控,规范临床路径、病历精准入组等方面取得巨大进步,取得了药耗成本和住院费用双下降,医院收治疑难重症水平不断提升,医疗机构收入结构明显改善的良好改革成效。
比如,浙江大学医学院附属妇产科医院在诊疗过程中,创新同种处方的药物管理收费模式,依据医嘱剂量与用药人数确定收费单位,兼顾临床需求与成本平衡,减少医保基金支出约2200万元,受益患者达22万人次;北京肿瘤医院从DRG手术病组的麻醉费用入手,实现多学科综合管理,促医疗机构内部管理机制完善;上海金山医院大数据赋能,精准聚焦关键病组和识别异动数据,实现了医保基金高效使用、医疗质量提升与资源动态平衡的“多方共赢”;北京协和医院基于DRG分组将炎症性肠病患者细分为不同组别,通过DRG指导下的医联体协作模式对患者进行精准分级诊疗。
推动三医协同治理。一是提高基金效率。通过DRG付费改革引导医疗机构规范诊疗、合理控制成本,提升医保基金使用效率。以北京市为例,实际付费医疗机构职工医保住院基金平均增长率为10%,比非实际付费医疗机构住院基金平均增长率低7个百分点。二是支持行业发展。各地在推进改革的同时,充分考虑以历史数据打包付费的影响,建立了特例单议,新药新技术除外支付等配套机制,促进临床技术进步,也进一步激发了医药产业的创新动力。
数智赋能:解锁未来DRG管理的制胜密码
随着DRG付费改革的深入推进,诊疗行为随之发生变化,数据规律展现出新的特征。在此背景下,以大数据赋能DRG管理成为必然选择。大数据技术不仅能够对海量医疗数据进行采集、清洗、转换和分析,实现对病例的自动分组和归类,计算出各DRG组的成本、费用、医保支付标准等指标,还能通过预测分析和趋势预警,提前发现潜在问题和风险,为医院和医保部门的决策提供前瞻性参考,助力医疗领域的可持续发展。
数智赋能分组方案编制
大数据+人工智能技术可深度挖掘医疗数据,依据疾病诊断、治疗方式及病情严重程度等因素,将病例精准划分至不同DRG组别,提升分组准确性,使医疗资源配置更加合理。通过构建全面、海量的医疗大数据模型,可以识别出病例特征对资源消耗的影响,按照“临床路径相似、资源消耗相近”的原则,形成核心分组结果建议,克服传统分组方案编制耗时耗力且易出错的问题。
数智赋能DRG审核及监管
通过建立“大数据模型+专家论证+人工智能算法”的模型,强化流程清单管理和专家审核口径管理,提升审核工作的效率和精准度,不断规范DRG付费医院行为,保障医保基金安全有效使用。利用人工智能与大数据技术,不仅能对历史数据进行深入分析,发现潜在的违规行为,还能自动检测重复报销、过度治疗和虚假报销等问题,有效提升医保监管系统的智能化水平。
数智赋能DRG费用预测
利用大数据技术进行DRG费用预测,可以更加精确地评估每个患者的医疗资源使用情况,预测医保基金的流动趋势,实现对医疗服务费用的合理控制,为决策者提供科学依据,帮助做出动态的资源调整。


- 10-21 2025
- 国内空白,又一款抗失眠新药首仿来袭|非特殊管制+非成瘾 依据中国睡眠研究会《2025年中国睡眠健康调查报告》,中国18岁及以上人群中,高达48.5%存在睡眠困扰,主要症状表现为入睡困难、夜间易醒及早醒等。随着年龄增长,睡眠困扰率呈现递增趋势,65岁及以上人群睡眠困扰率最高,达73.7%。 近日,2025年8月18日,根据中国国家药品审评中心(CDE)官网最新公示,朗天药业(湖北)有限公司按化药注册分类3类申报的雷美替胺片临床申请获默示许可。公开资料显示,雷美替胺(ramelteon)是一种选择性褪黑素受体激动剂,主要用于改善失眠症患者入睡困难。 雷美替胺一种褪黑激素受体激动剂,对于褪黑激素MT1和MT2都具有较高的亲和性,被认为具有促进睡眠的性质。通过激活大脑中的MT1和MT2受体,调节睡眠-觉醒周期,帮助改善入睡困难,且不显著影响正常睡眠结构。褪黑素是一种诱导自然睡眠的体内激素,它通过调节人的自然睡眠而克服睡眠障碍,提高睡眠质量。它与其他安眠药的最大区别在于,褪黑素无成瘾性,无明显副作用。 值得一提的是,雷美替胺是首个和迄今唯一无滥用和依赖性的失眠处方治疗药,也是第一个应用于临床治疗失眠的褪黑素受体激动剂,用于治疗以入睡困难为特征的失眠症。该原研药(商品名:Rozerem)是由日本武田公司研发,于2005年7月22日率先在美国上市,2008年在日本上市。 截至目前为止,雷美替胺片原研药尚未在国内上市,据CDE官网查询最新显示,国内已有南京正大天晴制药有限公司、四川科瑞德制药股份有限公司、朗天药业(湖北)有限公司3家药企提交了雷美替胺片临床申请,均获受理,目前处于临床阶段。 雷美替胺片作为一种治疗失眠的药物,尤其针对入睡困难型失眠症,因其独特的作用机制和安全性,具有一定的临床优势。 一、独特的作用机制 雷美替胺是首个应用于临床治疗失眠的褪黑素受体激动剂,它是一种选择性褪黑素受体激动剂,主要针对大脑中的MT1和MT2受体。这类似于你体内天然的褪黑素,但作用更精准强力。通过激活这些受体,它帮助调节你的睡眠-觉醒周期,更接近于生理性的睡眠诱导过程,这不同于传统安眠药通过抑制中枢神经系统来促眠的方式。用法简便:雷美替胺片的用法是每日一次,每次8mg,睡前30分钟内服用。需要注意的是,应避免与高脂肪餐同服,因为高脂肪餐可能会延迟药物的达峰时间。 二、较高的安全性 无成瘾性和依赖性:雷美替胺是首个和迄今唯一无滥用和依赖性的失眠处方治疗药。即使超剂量(20倍推荐量)亦未发现滥用倾向,无躯体依赖性证据。 不影响正常睡眠结构:它主要帮助你缩短入睡时间,不显著影响正常睡眠结构。 次日残留效应小:由于其半衰期短(原型药半衰期1-2.6小时,主要活性代谢物M-II半衰期2-5小时),并且每天服用未观察到蓄积,因此第二天通常不会感到昏昏沉沉的“宿醉感”。 常见不良反应相对较轻:虽然也可能有副作用,但常见的如嗜睡、头晕、乏力、恶心等通常程度较轻。当然,像任何药物一样,它也需要注意一些潜在的严重但罕见的不良反应,例如复杂睡眠行为(如梦游)、过敏反应等。 三、适用的患者人群 雷美替胺对于入睡困难为主的失眠患者效果较好。一些特殊人群用药也提供了参考: 老年人:75岁或以上老人和年轻成年受试者之间没有观察到安全性或有效性的总体差异。 肝功能不全患者:中度肝功能不全患者应慎用,严重肝功能不全患者则不建议使用。轻度肝功能损害受试者对雷美替胺的暴露增加四倍,中度肝功能损害受试者暴露于雷美替胺增加十倍以上。 肾功能不全患者:研究显示,肾功能不全患者服用雷美替胺后,其原型药物及代谢产物的峰浓度和血药浓度-时间曲线下面积均未受影响,因此肾功能不全患者无需调整雷美替胺用药剂量。 雷美替胺片为入睡困难型失眠症患者提供了一个具有独特作用机制、无成瘾性、整体安全性良好、更接近生理睡眠模式的治疗选择,特别适合那些关注药物依赖风险、希望避免次日嗜睡感的患者。尤其适合需要长期用药的患者以及对苯二氮䓬类药物成瘾风险有所顾虑的患者。随着国内药企对雷美替胺片仿制药的布局,将为广大入睡困难型失眠症患者提供新的治疗选择。
- 07-24 2025
- 朗天医药帕拉米韦吸入溶液启动II期临床 适应症为甲型或乙型流行性感冒 药物临床试验登记与信息公示平台数据显示,朗天医药科技(武汉)有限公司/朗天药业(湖北)有限公司的初步评价帕拉米韦吸入溶液治疗成人无并发症的单纯性流感的有效性及安全性的多中心、随机、双盲、安慰剂对照的Ⅱ期临床研究已启动。临床试验登记号为CTR20252729,首次公示信息日期为2025年7月22日。 该药物剂型为吸入制剂,用法用量为60mg(2ml:20mg,1支 + 2ml:40mg,1支)多次给药组三天每次分别为“1支2ml:20mg + 1支2ml:40mg”;80mg(2ml:40mg,2支)多次给药组三天每次分别为“2支2ml:40mg”;80mg(2ml:40mg,2支)单次给药组每次2ml:40mg,2支,用药时程为3天为一个吸入给药周期,共吸入给药一个周期。本次试验目的是考察不同剂量帕拉米韦吸入溶液对比安慰剂治疗成人无并发症的单纯性流感的安全性及有效性,为疗效确证阶段给药方案的确定提供依据。 帕拉米韦吸入溶液为化学药物,适应症为甲型或乙型流行性感冒。流感是流感病毒引起的急性呼吸道传染病,症状有高热、乏力、头痛、咳嗽等。通过症状、流感抗原检测等诊断,治疗可用抗病毒药物。 本次试验主要终点指标包括流感病毒转阴的时间(单位:小时),定义为从开始研究治疗至首次流感病毒RNA低于最低检测限的时间【通过定量PCR方法进行测定】;次要终点指标包括流感病毒转阴时间、病毒RNA及滴度变化、病毒载量AUC等多项有效性指标,以及不良事件等安全性指标。 目前,该实验状态为进行中(尚未招募),目标入组人数240人。
- 07-22 2025
- 2025年医保目录调整工作启动 2025年07月22日 来源:中国医药报 记者 郭婷 近日,国家医保局发布《2025年国家基本医疗保险、生育保险和工伤保险药品目录及商业健康保险创新药品目录调整工作方案》(以下简称《工作方案》)等相关文件,启动2025年国家基本医疗保险、生育保险和工伤保险药品目录(以下简称基本目录)及商业健康保险创新药品目录(以下简称商保创新药目录)调整工作。《工作方案》释放出“真支持创新、支持真创新、支持差异化创新”的强烈信号,最大亮点当属将制定第一版商保创新药目录,为高值创新药支付提供新通道。 商保创新药目录是业界关注的焦点。根据《工作方案》,2025年将制定第一版商保创新药目录,主要聚焦创新程度高、临床价值大、患者获益显著,但因超出“保基本”定位暂时无法纳入基本目录的药品。在5年内批准上市的新通用名或治疗罕见病的独家药品可以申报。 数据显示,自2020年以来,截至今年上半年,共有210余个创新药获批上市。其中,有部分创新药上市多年,但因价格较高无法进入“保基本”的基本目录。例如,备受关注的CAR-T细胞治疗产品阿基仑赛注射液、瑞基奥仑赛注射液,ADC药物注射用德曲妥珠单抗等产品因价格高昂,多次冲刺基本目录未果。商保创新药目录为这类高值创新药提供了一个新通道。 与基本目录价格谈判不同,商保创新药目录通过协商确定价格,商保专家对药品是否能够进入商保创新药目录以及是否能够进行价格协商具有重要决策权。根据《工作方案》,在价格谈判/协商阶段(2025年9月—10月),组织企业进行现场价格协商,协商成功的药品纳入商保创新药目录,并签署协议;经专家评审建议既可以调入基本目录也可以调入商保创新药目录的药品,应先开展基本目录谈判,谈判失败的进入价格协商环节。 进入商保创新药目录的药品能享受哪些政策支持?国家医保局表示,将探索优化调整支付管理政策,对于商保创新药目录内药品给予“三除外”支持,即可不计入基本医保自费率指标,不纳入集采中选可替代品种监测的范围,符合条件的商业健康保险保障范围内的创新药应用病例可不纳入按病种付费范围,经审核评议程序后支付。 针对2025年国家医保基本目录调整,《工作方案》显示,将继续向罕见病、儿童用药倾斜。目录外新通用名药品、新适应证药品的申报仍以2020年1月1日至2025年6月30日期间划定界线,但纳入鼓励研发申报儿童药品清单或罕见病治疗药品,仅需满足在2025年6月30日前经国家药监部门批准上市即可。此外,坚持调进调出并重,建立目录内药品配备情况监测机制,对于临床价值不高且可被其他品种替代、长期未生产使用、无法保障有效供应的药品,重点考虑调出基本目录。 值得注意的是,《工作方案》还明确提出,在5年内批准上市的新通用名或治疗罕见病的独家药品,可以单独申报商保创新药目录或同时申报商保创新药目录、基本目录。
- 04-24 2025
- 解析DRG支付方式改革路径 “截至目前,全国393个统筹地区中实施按病组(DRG)付费191个、按病种分值(DIP)付费200个,天津与上海兼具两种付费模式,实现了统筹地区全覆盖、符合条件的医疗机构全覆盖、病种覆盖率达到95%、医保基金覆盖率达到80%。”4月18日,2025年医保支付方式改革蓝皮书发布会暨趋势交流会上,国家医保局医药服务管理司副司长徐娜介绍了当前医保支付改革取得的积极成效。 据悉,此前医保基金采取“按项目”付费的方式,虽然简单便捷,但容易诱发医疗费用过快增长、“过度医疗”屡禁不绝等问题,医务人员劳动价值也没有充分体现。而DRG/DIP付费则是通过对疾病诊疗分组或折算分值,进行“打包”付费,能够进一步规范诊疗行为。 历经多年探索,我国DRG改革形成了“顶层设计—试点先行—全国推广”的推进路径。从2019年整合国内主流分组版本推出1.0版方案,到2024年2.0版通过多学科联合论证、人工智能算法等数智技术实现分组科学性跃升,分组方案持续迭代优化,核心分组从376个增至409个,细分组从618个扩展至634个,精准匹配临床多学科诊疗趋势,回应“挑选病人”“机械控费”等改革痛点,改革成效惠及全国。 分组方案迭代至2.0:从无到优,破解支付改革痛点问题 分组方案是医保支付方式改革的重要支撑,政府工作报告提出要深化医保支付方式改革。支付方式改革使得全国大部分地区群众就诊经济负担显著下降、医保基金使用效率提升,但还是有少数医疗机构出现了临床“挑选病人”、医生“拿着计算器看病”等现象。为进一步深化改革、完善支付环节,我国推出了2.0版分组方案。 DRG分组方案是DRG付费理论和我国医疗保障实践相结合的成果,也是以我国医疗服务特点和医保实际费用数据为基础形成的,用于全国医保DRG付费的统一权威分组版本。 1.0版分组方案(2019):整合当时国内主流应用的四个DRG版本,广泛吸收了各个版本在各自领域的应用经验,设置了核心分组376个,细分组618个。 1.1版分组方案(2021):为充分分析数据规律,在临床专家论证的基础上,通过建立超算实验室,利用30个试点城市改革数据,分析年龄、离院方式、合并症并发症等因素对医疗资源消耗的影响,编制形成1.1版本,包含核心分组376个,细分组628个。 2.0版分组方案(2024):一方面,为进一步匹配临床实际情况,顺应临床由单科或全院会诊转向多学科诊疗模式的发展趋势,在单个学科独立论证的基础上,建立多专业联合论证模式,并重点考虑了联合手术、复合手术问题。另一方面,数智赋能方案更科学。 通过引入人工智能算法,从临床专业知识、数据编码规范、DRG技术评价等多目标维度建立遗传算法模型,编制分组方案,并应用麻醉风险分级对分组结果进行校验。该版本分组方案核心分组409个,细分组634个,有效回应了临床诉求,体现了“医保医疗相向而行、协同发展”的价值导向,同时,通过大数据赋能进一步提升了分组方案的科学性。 持续优化:构建四大机制,凝聚多学科共识赋能支付改革 一是组建技术专家团队。专家团队是推动DRG付费改革落地实施、行稳致远的重要保障。目前,技术指导组拥有400多人的专家团队,涵盖临床、统计、病案等多个专业,为核心分组论证、细分组统计分析、审核监管、数据监测提供强大的专业支持。以临床论证工作为例,技术工作组与中华医学会、中华口腔医学会保持了长期的密切合作,分学科组建了31个临床论证小组,汇聚了临床专家169人,并为各小组配备63名医保专家、33名编码专家,形成了由265人组成的临床专家团队。 二是建立意见收集机制。支付方式改革涉及多方利益,如果没有广泛的社会共识,改革就难以顺利进行。在分组方案编制过程中,技术指导组广泛收集医保行政和经办部门、行业协会、医疗机构以及医药产业的意见和建议,并对收集的近万条建议进行深入分析,在2.0版分组方案中采纳了合理化建议近8000条,充分凝聚了社会共识。 三是构建沟通协商机制。技术指导组高度重视与临床的沟通协商,核心分组编制工作依托中华医学会、中华口腔医学会,召开了36场专题临床论证会,共计700余名专家参与论证,2.0版分组方案充分凝聚了行业共识。 四是建立动态调整机制。技术指导组高度重视行业发展对分组方案的影响,密切关注临床技术发展和诊疗服务优化、医疗费用数据规律变化以及科技发展带来的技术手段升级,并依据上述情况的发展,动态调整分组方案。 改革成效显著:提质增效,赋能三医协同治理新图景 增强人民群众就医获得感。改革后医疗机构诊疗行为更加规范,次均费用降低,参保群众的就医费用负担不断减轻,时间和费用消耗指数下降,平均住院日缩短,节省了参保群众的就医费用和时间成本。例如,吉林省2024年上半年医疗总费用157.25亿,较2023年下降18.42%;次均住院费用9379.96元,较2023年下降16.16%。重庆市实施DRG实际付费后,规范了用药、检查、检验、诊治等医疗服务行为,患者自负费用下降了21.54%。贵州省六盘水市居民次均住院费用同比下降了2.1%,职工同比下降7.7%,人均自付费用同比下降1.1%。 推动医疗机构高质量发展。在DRG付费改革过程中,各地医疗机构主动配合改革、不断创新,在干中学,学中干,在病案管理结算清单的指控,规范临床路径、病历精准入组等方面取得巨大进步,取得了药耗成本和住院费用双下降,医院收治疑难重症水平不断提升,医疗机构收入结构明显改善的良好改革成效。 比如,浙江大学医学院附属妇产科医院在诊疗过程中,创新同种处方的药物管理收费模式,依据医嘱剂量与用药人数确定收费单位,兼顾临床需求与成本平衡,减少医保基金支出约2200万元,受益患者达22万人次;北京肿瘤医院从DRG手术病组的麻醉费用入手,实现多学科综合管理,促医疗机构内部管理机制完善;上海金山医院大数据赋能,精准聚焦关键病组和识别异动数据,实现了医保基金高效使用、医疗质量提升与资源动态平衡的“多方共赢”;北京协和医院基于DRG分组将炎症性肠病患者细分为不同组别,通过DRG指导下的医联体协作模式对患者进行精准分级诊疗。 推动三医协同治理。一是提高基金效率。通过DRG付费改革引导医疗机构规范诊疗、合理控制成本,提升医保基金使用效率。以北京市为例,实际付费医疗机构职工医保住院基金平均增长率为10%,比非实际付费医疗机构住院基金平均增长率低7个百分点。二是支持行业发展。各地在推进改革的同时,充分考虑以历史数据打包付费的影响,建立了特例单议,新药新技术除外支付等配套机制,促进临床技术进步,也进一步激发了医药产业的创新动力。 数智赋能:解锁未来DRG管理的制胜密码 随着DRG付费改革的深入推进,诊疗行为随之发生变化,数据规律展现出新的特征。在此背景下,以大数据赋能DRG管理成为必然选择。大数据技术不仅能够对海量医疗数据进行采集、清洗、转换和分析,实现对病例的自动分组和归类,计算出各DRG组的成本、费用、医保支付标准等指标,还能通过预测分析和趋势预警,提前发现潜在问题和风险,为医院和医保部门的决策提供前瞻性参考,助力医疗领域的可持续发展。 数智赋能分组方案编制 大数据+人工智能技术可深度挖掘医疗数据,依据疾病诊断、治疗方式及病情严重程度等因素,将病例精准划分至不同DRG组别,提升分组准确性,使医疗资源配置更加合理。通过构建全面、海量的医疗大数据模型,可以识别出病例特征对资源消耗的影响,按照“临床路径相似、资源消耗相近”的原则,形成核心分组结果建议,克服传统分组方案编制耗时耗力且易出错的问题。 数智赋能DRG审核及监管 通过建立“大数据模型+专家论证+人工智能算法”的模型,强化流程清单管理和专家审核口径管理,提升审核工作的效率和精准度,不断规范DRG付费医院行为,保障医保基金安全有效使用。利用人工智能与大数据技术,不仅能对历史数据进行深入分析,发现潜在的违规行为,还能自动检测重复报销、过度治疗和虚假报销等问题,有效提升医保监管系统的智能化水平。 数智赋能DRG费用预测 利用大数据技术进行DRG费用预测,可以更加精确地评估每个患者的医疗资源使用情况,预测医保基金的流动趋势,实现对医疗服务费用的合理控制,为决策者提供科学依据,帮助做出动态的资源调整。
 朗天医药集团各企业开票信息
尊敬的合作伙伴:
以下为朗天医药集团下属各企业的开票信息,敬请合作单位在需要时使用。
感谢您的支持!
朗天医药集团
2023年7月
湖北朗天医药有限公司开票信息
公 司 名 称
湖北朗天医药有限公司
纳税人识别号
91420222309808120W
地 址
湖北省黄石市阳新县宝成路6号阳新总部经济示范园科创中心大楼201室
电 话
0714-3509518
开 户 行
中国农业银行阳新县支行
账 号
17170101040012858
朗天药业(湖北)有限公司开票信息
公 司 名 称
朗天药业(湖北)有限公司
纳税人识别号
914202007641391760
地 址
黄石市下陆区大泉路120号
电 话
0714-6354581
开 户 行
中国银行黄石分行营业部
账 号
556057530486
武汉朗天医药发展有限公司开票信息
公 司 名 称
武汉朗天医药发展有限公司
纳税人识别号
9142010077138804XD
地 址
武汉东湖新技术开发区凌家山南路1号武汉光谷企业天地4号楼3层03号、04号、05号、06号
电 话
027-65529266
开 户 行
中国建设银行股份有限公司武汉宝谷支行
账 号
42001127138053000083
朗天医药科技(武汉)有限公司开票信息
公 司 名 称
朗天医药科技(武汉)有限公司
纳税人识别号
91420100MACHXYBM78
地 址
湖北省武汉市东湖新技术开发区凌家山南路1号武汉光谷企业天地4号楼3层01号(自贸区武汉片区)
电 话
027-87170755
开 户 行
汉口银行湖北自贸试验区武汉片区分行
账 号
005111000061515
朗天医药集团各企业开票信息
尊敬的合作伙伴:
以下为朗天医药集团下属各企业的开票信息,敬请合作单位在需要时使用。
感谢您的支持!
朗天医药集团
2023年7月
湖北朗天医药有限公司开票信息
公 司 名 称
湖北朗天医药有限公司
纳税人识别号
91420222309808120W
地 址
湖北省黄石市阳新县宝成路6号阳新总部经济示范园科创中心大楼201室
电 话
0714-3509518
开 户 行
中国农业银行阳新县支行
账 号
17170101040012858
朗天药业(湖北)有限公司开票信息
公 司 名 称
朗天药业(湖北)有限公司
纳税人识别号
914202007641391760
地 址
黄石市下陆区大泉路120号
电 话
0714-6354581
开 户 行
中国银行黄石分行营业部
账 号
556057530486
武汉朗天医药发展有限公司开票信息
公 司 名 称
武汉朗天医药发展有限公司
纳税人识别号
9142010077138804XD
地 址
武汉东湖新技术开发区凌家山南路1号武汉光谷企业天地4号楼3层03号、04号、05号、06号
电 话
027-65529266
开 户 行
中国建设银行股份有限公司武汉宝谷支行
账 号
42001127138053000083
朗天医药科技(武汉)有限公司开票信息
公 司 名 称
朗天医药科技(武汉)有限公司
纳税人识别号
91420100MACHXYBM78
地 址
湖北省武汉市东湖新技术开发区凌家山南路1号武汉光谷企业天地4号楼3层01号(自贸区武汉片区)
电 话
027-87170755
开 户 行
汉口银行湖北自贸试验区武汉片区分行
账 号
005111000061515
 朗天医药欢迎各地嘉宾参加87届全国药品交易会(广州)
尊敬的客户:
第87届全国药品交易会将于2023年12月5-7日在广州·中国进出口商品交易会展馆举行,朗天医药集团热忱欢迎各地嘉宾莅临我司展位或驻地酒店沟通友谊,洽谈合作,共商发展。
朗天展位:广州·中国进出口商品交易会展馆A区2.1号馆,展位号:2.1P06
展会地址:中国广东省广州市海珠区阅江中路 380号
驻地酒店:广交会威斯汀酒店(广州海珠区凤浦中路681号广交会展馆C区)
参展人员:集团董事长、营销中心高管、驻地销售经理
随时恭候您联系我们!
联系电话:蔡先生13018063138,王先生13911133576,陆先生18945661717、包先生18615586288,张先生13544448655
朗天医药集团
二〇二三年十月二十七日
朗天医药欢迎各地嘉宾参加87届全国药品交易会(广州)
尊敬的客户:
第87届全国药品交易会将于2023年12月5-7日在广州·中国进出口商品交易会展馆举行,朗天医药集团热忱欢迎各地嘉宾莅临我司展位或驻地酒店沟通友谊,洽谈合作,共商发展。
朗天展位:广州·中国进出口商品交易会展馆A区2.1号馆,展位号:2.1P06
展会地址:中国广东省广州市海珠区阅江中路 380号
驻地酒店:广交会威斯汀酒店(广州海珠区凤浦中路681号广交会展馆C区)
参展人员:集团董事长、营销中心高管、驻地销售经理
随时恭候您联系我们!
联系电话:蔡先生13018063138,王先生13911133576,陆先生18945661717、包先生18615586288,张先生13544448655
朗天医药集团
二〇二三年十月二十七日


- 07-25 2023
- 朗天医药集团各企业开票信息 尊敬的合作伙伴: 以下为朗天医药集团下属各企业的开票信息,敬请合作单位在需要时使用。 感谢您的支持! 朗天医药集团 2023年7月 湖北朗天医药有限公司开票信息 公 司 名 称 湖北朗天医药有限公司 纳税人识别号 91420222309808120W 地 址 湖北省黄石市阳新县宝成路6号阳新总部经济示范园科创中心大楼201室 电 话 0714-3509518 开 户 行 中国农业银行阳新县支行 账 号 17170101040012858 朗天药业(湖北)有限公司开票信息 公 司 名 称 朗天药业(湖北)有限公司 纳税人识别号 914202007641391760 地 址 黄石市下陆区大泉路120号 电 话 0714-6354581 开 户 行 中国银行黄石分行营业部 账 号 556057530486 武汉朗天医药发展有限公司开票信息 公 司 名 称 武汉朗天医药发展有限公司 纳税人识别号 9142010077138804XD 地 址 武汉东湖新技术开发区凌家山南路1号武汉光谷企业天地4号楼3层03号、04号、05号、06号 电 话 027-65529266 开 户 行 中国建设银行股份有限公司武汉宝谷支行 账 号 42001127138053000083 朗天医药科技(武汉)有限公司开票信息 公 司 名 称 朗天医药科技(武汉)有限公司 纳税人识别号 91420100MACHXYBM78 地 址 湖北省武汉市东湖新技术开发区凌家山南路1号武汉光谷企业天地4号楼3层01号(自贸区武汉片区) 电 话 027-87170755 开 户 行 汉口银行湖北自贸试验区武汉片区分行 账 号 005111000061515
- 10-27 2023
- 朗天医药欢迎各地嘉宾参加87届全国药品交易会(广州) 尊敬的客户: 第87届全国药品交易会将于2023年12月5-7日在广州·中国进出口商品交易会展馆举行,朗天医药集团热忱欢迎各地嘉宾莅临我司展位或驻地酒店沟通友谊,洽谈合作,共商发展。 朗天展位:广州·中国进出口商品交易会展馆A区2.1号馆,展位号:2.1P06 展会地址:中国广东省广州市海珠区阅江中路 380号 驻地酒店:广交会威斯汀酒店(广州海珠区凤浦中路681号广交会展馆C区) 参展人员:集团董事长、营销中心高管、驻地销售经理 随时恭候您联系我们! 联系电话:蔡先生13018063138,王先生13911133576,陆先生18945661717、包先生18615586288,张先生13544448655 朗天医药集团 二〇二三年十月二十七日
-
关于朗天
查看详情朗天医药集团深圳总部位于福田中央商务区内,武汉总部位于东湖高新区光谷企业天地,是集药品生产、市场营销、新药研发、学术支持为一体的现代化高科技医药产业集团。
集团董事长蔡翔先生带领朗天人与时俱进,顺势而为,努力实现一次次科技创新和模式创新,不断提高公司的发展力和竞争力。揽四方菁华,纳八面来风,朗天正站在一个新的历史起点上。 朗天集团医药产业集群包括:深圳市朗天投资有限公司、湖北朗天医药有限公司(GSP)、武汉朗天医药发展有限公司(GSP)、朗天药业(湖北)有限公司(GMP)、黄石市化学药物产业技术研究院等。公司从竞争激烈的医药行业中脱颖而出,在新药特药的运营领域处于国内领先地位。
查看详情亲爱的朋友们:
大家好!
朗天医药自2004年11月18日起成立以来,通过不懈的努力和奋斗,在医药研发、医药商业、制药工业等板块取得了长足发展,不断实现新的突破,特别是在新药特药的运营领域,目前在国内处于领先地位,发展成为集研发、生产、营销和学术推广于一体的高科技医药产业集团。
查看详情集团愿景
致力于成为中国新特药领域的一流企业。
集团使命
你若安好,便是朗天。
经营理念
坚持诚信,走精品路线。
-







 创新研发
R & D innovation
创新研发
R & D innovation
 智能制造
Intelligent manufacturing
智能制造
Intelligent manufacturing
 明星产品
Star products
明星产品
Star products
 人才招聘
Talent recruitment
人才招聘
Talent recruitment